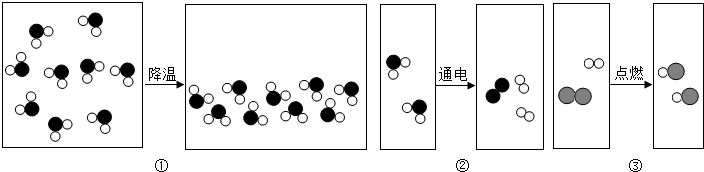
14.金属冶炼就是要把金属从化合态变成游离态,使金属氧化物还原成金属单质,如图为有关实验室用一氧化碳还原氧化铜的实验装置,装置乙中的溶液为澄清石灰水,请回答与该实验有关的问题:

(1)实验时,从甲装置的玻璃管中观察到
的现象是黑色固体变成红色
(2)装置乙中发生反应的化学方程式是CO2+Ca(OH)2=CaCO3↓+H2O
(3)现有含杂质的氧化铜样品10g(假设杂质不参加反应),为测定该样品中氧化铜的质量分数,某同学用如图所示的装置进行实验,得到下列两组数据:
关于这两组数据,下列说法不正确的是BD(选填相关的字母)
A、玻璃管中固体减少的质量即为氧化铜中氧元素的质量
B、利用这两个数据都可以计算出样品中氧化铜的质量分数
C、装置乙中石灰水增重的质量与反应产生二氧化碳的质量不相等
D、如果实验称量很准确,则玻璃管中固体减少的质量应等于装置乙中石灰水增重的质量
(4)通过计算该样品中氧化铜的质量分数为90%.

(1)实验时,从甲装置的玻璃管中观察到
的现象是黑色固体变成红色
(2)装置乙中发生反应的化学方程式是CO2+Ca(OH)2=CaCO3↓+H2O
(3)现有含杂质的氧化铜样品10g(假设杂质不参加反应),为测定该样品中氧化铜的质量分数,某同学用如图所示的装置进行实验,得到下列两组数据:
| 反应前 | 氧化铜完全反应后 | |
| Ⅰ组 | 洗气瓶和石灰水的质量为185g | 洗气瓶和瓶内物质的总质量为187g |
| Ⅱ组 | 玻璃管和氧化铜样品的质量为57.9g | 玻璃管和玻璃管内物质的质量为56.1g |
A、玻璃管中固体减少的质量即为氧化铜中氧元素的质量
B、利用这两个数据都可以计算出样品中氧化铜的质量分数
C、装置乙中石灰水增重的质量与反应产生二氧化碳的质量不相等
D、如果实验称量很准确,则玻璃管中固体减少的质量应等于装置乙中石灰水增重的质量
(4)通过计算该样品中氧化铜的质量分数为90%.
12.工业上以高纯度的二氧化锰为原料制备高锰酸钾的主要流程如下:

已知相关物质的溶解度(20℃)如表:
(1)KMnO4中锰元素的化合价为+7.
(2)操作I 的名称是过滤.“干燥”过程中温度不宜过高的原因是2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑(用化学方程式表示).
(3)“通CO2酸化”,反应的化学方程式为:3K2 MnO4+2CO2═2KMnO4+MnO2↓+2K2 CO3若用稀H2SO4酸化,反应的化学方程式为:3K2 MnO4+2H2 SO4═2KMnO4+MnO2↓+2K2SO4+2H2O 工业上不采用稀H2SO4酸化的原因是相同条件下,硫酸钾和高锰酸钾的溶解度都比较小,无法采用浓缩结晶的方法加以分离.
(4)电解法也可以实现由K2MnO4向KMnO4的转化,反应的化学方程式为:2K2MnO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2KMnO4+2KOH+H2,与“通CO2酸化”相比,其优点是生成的氢氧化钾可以循环使用.

已知相关物质的溶解度(20℃)如表:
| 物质 | K2CO3 | K2SO | KMnO4 |
| 溶解度/g | 111 | 11.1 | 6.34 |
(2)操作I 的名称是过滤.“干燥”过程中温度不宜过高的原因是2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑(用化学方程式表示).
(3)“通CO2酸化”,反应的化学方程式为:3K2 MnO4+2CO2═2KMnO4+MnO2↓+2K2 CO3若用稀H2SO4酸化,反应的化学方程式为:3K2 MnO4+2H2 SO4═2KMnO4+MnO2↓+2K2SO4+2H2O 工业上不采用稀H2SO4酸化的原因是相同条件下,硫酸钾和高锰酸钾的溶解度都比较小,无法采用浓缩结晶的方法加以分离.
(4)电解法也可以实现由K2MnO4向KMnO4的转化,反应的化学方程式为:2K2MnO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2KMnO4+2KOH+H2,与“通CO2酸化”相比,其优点是生成的氢氧化钾可以循环使用.
9.下列各组对比实验,不能达到实验目的是( )
| 实验目的 | 实验方案 | ||
| 实验① | 实验② | ||
| A. | 探究Zn、Fe、Cu 的活动性强弱 |  |  |
| B. | 探究温度对反应剧烈程度的影响 |  |  |
| C. | 探究催化剂对反应快慢的影响 |  |  |
| D. | 探究CO2 的物理性质和化学性质 |  |  |
| A. | A | B. | B | C. | C | D. | D |
8.钛铁矿(钛 Ti)的主要成分是FeTiO3.下列说法正确的是( )
| A. | FeTiO3中Fe、Ti、O 元素的质量比是56:48:16 | |
| B. | FeTiO3的相对分子质量是56+48+16 | |
| C. | FeTiO3中Fe、Ti、O 的原子个数比是1:1:1 | |
| D. | FeTiO3中Ti 元素的质量分数是$\frac{48}{56+48+16×3}$×100% |
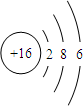
7.如图是元素X 的原子结构示意图,下列说法正确的是( )
0 149848 149856 149862 149866 149872 149874 149878 149884 149886 149892 149898 149902 149904 149908 149914 149916 149922 149926 149928 149932 149934 149938 149940 149942 149943 149944 149946 149947 149948 149950 149952 149956 149958 149962 149964 149968 149974 149976 149982 149986 149988 149992 149998 150004 150006 150012 150016 150018 150024 150028 150034 150042 211419

| A. | 该原子的核内电子数为16 | B. | 该原子最外电子层达到了稳定结构 | ||
| C. | X 属于非金属元素 | D. | X 与Na 生成化合物NaX |

 某同学在实验室的试剂柜中发现一瓶失去标签的无色溶液,可能是硝酸、硝酸镁、硝酸铁、硝酸钾中的一种,为了确定该药品,进行下列实验:
某同学在实验室的试剂柜中发现一瓶失去标签的无色溶液,可能是硝酸、硝酸镁、硝酸铁、硝酸钾中的一种,为了确定该药品,进行下列实验: