3.被称为“生命之源”的水(H2O)和被称为“绿色氧化剂”的双氧水(H2O2),都是由氢、氧两种元素组成的化合物,通常情况下均为无色液体.在化学实验开放日,实验小组的同学用下面的方法鉴别水和双氧水两瓶无色液体,请填写有关内容:
(1)B试管中发生反应的化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
(2)如何验证B试管中产生的气体(写出操作步骤、实验现象和结论)?
| 实验步骤 | 实验现象 | 实验结论 |
| ①将等体积的两种无色液体分别加入A、B两个试管中. ②分别向A、B两试管中同时加入等质量(少量)的二氧化锰,观察现象.  | A试管中无明显现象 B试管中有气泡产生 | A试管中的无色液体是: 水; B试管中的无色液体是: 过氧化氢; |
(2)如何验证B试管中产生的气体(写出操作步骤、实验现象和结论)?
1.做铁丝在氧气中燃烧的实验时,集气瓶要预先装少量水或铺一薄层细沙,目的是( )
| A. | 降温,防止反应过于激烈 | |
| B. | 防止产生热量 | |
| C. | 使现象明显 | |
| D. | 防止生成物熔化后溅落瓶底,使瓶底炸裂 |
20.鉴别空气、氧气和二氧化碳三瓶气体的最简便的方法是( )
| A. | 将气体通入澄清石灰水 | B. | 闻气体的气味 | ||
| C. | 用带火星的木条伸入集气瓶中 | D. | 用燃着的木条伸入集气瓶中 |
19.生活中处处离不开化学,下列化学物质对人类有益的是( )
①使用加碘食盐
②使用铝制炊具
③食用含铁酱油
④食用含磷洗衣粉
⑤食用含钙麦片
⑥使用氟利昂作制冷剂.
①使用加碘食盐
②使用铝制炊具
③食用含铁酱油
④食用含磷洗衣粉
⑤食用含钙麦片
⑥使用氟利昂作制冷剂.
| A. | ①③⑤ | B. | ①②③⑤ | C. | ③④⑥ | D. | ①②③④⑤⑥ |
18.下列四个短语,其原意一定包含化学变化的是( )
| A. | 花香四溢 | B. | 海市蜃楼 | C. | 百炼成钢 | D. | 木已成舟 |
17.某兴趣小组同学对实验室制备氧气的条件进行深入探究,请你参与:
【探究活动一】为探究催化剂的种类对氯酸钾分解速率的影响,甲同学设计如表对比实验:
(1)表Ⅱ中x的值应为3.0;通过分析上表数据,可以得出的实验结论是:在相同的条件下,KClO3在MnO2作催化剂比CuO作催化剂的分解速率快(选填“快”或“慢”)
【探究活动二】为探究双氧水浓度对过氧化氢分解速率的影响,乙同学设计以下实验:
[进行实验]
室温下,选用50.0g不同溶质质量分数的双氧水(1%、2%和4%)分别与0.1g二氧化锰进行实验(如图1,固定夹持仪器略去).
(2)MnO2在H2O2分解前后其质量和化学性质没有发生改变,写出H2O2分解的化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(3)按右图装置进行实验,在装药品前应检查该装置的气密性,具体做法是关闭分液漏斗活塞,加热锥形瓶,如果注射器活塞外移(右移),停止加热后注射器活塞回到原来位置,则装置的气密性良好.其中注射器的作用是测量生成气体的体积.

[数据处理]
(4)乙同学进行实验后,获得的相关实验数据记录如表所示:
①本实验中,测量O2体积的装置也可以选用如图2的哪套装置来代替C(填编号).
②分析上表数据,可以得出不同浓度的双氧水对过氧化氢分解速率影响的结论是:在相同条件下,双氧水浓度越大,过氧化氢的分解速率越快.
[拓展延伸]
(5)丙同学认为用图3装置进行实验,通过比较相同时间天平读数差值大小也能探究双氧水浓度对过氧化氢分解速率的影响.
(6)如表是实验时记录生成的二氧化碳气体体积和对应的时间的一组实验数据(每间隔4S读数一次):
从上表数据可以分析得出,反应时间为36S时双氧水与二氧化锰恰好完全反应;
反应过程中过氧化氢的分解速率先快后慢的主要原因是双氧水在二氧化锰作催化剂下分解反应是放热反应,使得开始时溶液温度升高,过氧化氢的分解速率加快.然后随着反应的不断进行,双氧水的浓度逐渐变小,过氧化氢的分解速率变慢.
(7)通过以上探究,你认为影响过氧化氢分解速率的因素还有温度(填一条即可),请设计实验方案验证你的猜想分别取两份质量相等的二氧化锰放入两支试管中,然后分别加入体积和浓度相同,但温度不同的双氧水,比较其分解速率.
【探究活动一】为探究催化剂的种类对氯酸钾分解速率的影响,甲同学设计如表对比实验:
| 氯酸钾的质量 | 催化剂的种类 | MnO2的质量 | 反应条件 | 收集45.0mL O2所需的时间(S) | |
| Ⅰ | 3.0g | MnO2 | 1.0g | 混合加热 | 21 |
| Ⅱ | xg | CuO | 1.0g | 混合加热 | 48 |
【探究活动二】为探究双氧水浓度对过氧化氢分解速率的影响,乙同学设计以下实验:
[进行实验]
室温下,选用50.0g不同溶质质量分数的双氧水(1%、2%和4%)分别与0.1g二氧化锰进行实验(如图1,固定夹持仪器略去).
(2)MnO2在H2O2分解前后其质量和化学性质没有发生改变,写出H2O2分解的化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(3)按右图装置进行实验,在装药品前应检查该装置的气密性,具体做法是关闭分液漏斗活塞,加热锥形瓶,如果注射器活塞外移(右移),停止加热后注射器活塞回到原来位置,则装置的气密性良好.其中注射器的作用是测量生成气体的体积.

[数据处理]
(4)乙同学进行实验后,获得的相关实验数据记录如表所示:
| 双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 温度 | 相同时间(10S)内产生O2体积(mL) | |
| Ⅰ | 50.0g | 1% | 0.1g | 20℃ | 9 |
| Ⅱ | 50.0g | 2% | 0.1g | 20℃ | 16 |
| Ⅲ | 50.0g | 4% | 0.1g | 20℃ | 31 |
②分析上表数据,可以得出不同浓度的双氧水对过氧化氢分解速率影响的结论是:在相同条件下,双氧水浓度越大,过氧化氢的分解速率越快.
[拓展延伸]
(5)丙同学认为用图3装置进行实验,通过比较相同时间天平读数差值大小也能探究双氧水浓度对过氧化氢分解速率的影响.
(6)如表是实验时记录生成的二氧化碳气体体积和对应的时间的一组实验数据(每间隔4S读数一次):
| 时间/S | 4 | 8 | 12 | 16 | 20 | 24 | 28 | 32 | 36 | 40 |
| 气体体积/mL | 16.0 | 22.2 | 29.4 | 39.3 | 50.4 | 57.6 | 62.0 | 64.7 | 66.0 | 66.0 |
反应过程中过氧化氢的分解速率先快后慢的主要原因是双氧水在二氧化锰作催化剂下分解反应是放热反应,使得开始时溶液温度升高,过氧化氢的分解速率加快.然后随着反应的不断进行,双氧水的浓度逐渐变小,过氧化氢的分解速率变慢.
(7)通过以上探究,你认为影响过氧化氢分解速率的因素还有温度(填一条即可),请设计实验方案验证你的猜想分别取两份质量相等的二氧化锰放入两支试管中,然后分别加入体积和浓度相同,但温度不同的双氧水,比较其分解速率.
16.2013年4月昆明发生抵制PX化工项目的活动,PX被人们贴上“剧毒物质”“致癌物质”的标签,导致国人闻之色变.PX的化学式是C8H10,是“对二甲苯”(paraxylene)的英文缩写,它究竟是一种什么样的物质?请阅读下列信息:
根据上述信息,请你回答下列问题:
(1)根据物质的组成对PX分类,它属于有机物(填“有机物”或“无机物”);
(2)上表中属于PX物理性质的是①②③④⑥(填性质代号);
(3)根据PX的性质,从防止环境污染和安全的角度,应如何保存和储运PX?密封保存、严禁烟火.
0 149785 149793 149799 149803 149809 149811 149815 149821 149823 149829 149835 149839 149841 149845 149851 149853 149859 149863 149865 149869 149871 149875 149877 149879 149880 149881 149883 149884 149885 149887 149889 149893 149895 149899 149901 149905 149911 149913 149919 149923 149925 149929 149935 149941 149943 149949 149953 149955 149961 149965 149971 149979 211419
| PX的 性质 | ①无色透明液体;②熔点13.2℃、沸点138.5℃;③密度0.86g/cm3;④有芳香气味;⑤可燃;⑥有挥发性,但比汽油低;⑦低毒,毒性与汽油相当;在致癌性上,按国际惯例属于第三类致癌物,即缺乏证据证明其具有致癌性;⑧遇火可爆炸,但爆炸性比汽油低(爆炸极限为1.1%~7.0%) |
| PX的 用途 | 化学工业的重要原料,用于纺织、塑料、建材、医药、农药等方面,如雪纺衣物、口罩、尼龙绳、塑料保鲜盒和保鲜袋等,涉及衣食住行的方方面面,目前我国每年“供”小于“需”,有近一半的PX是靠进口 |
(1)根据物质的组成对PX分类,它属于有机物(填“有机物”或“无机物”);
(2)上表中属于PX物理性质的是①②③④⑥(填性质代号);
(3)根据PX的性质,从防止环境污染和安全的角度,应如何保存和储运PX?密封保存、严禁烟火.

 所示装置可用来测定空气中氧气的含量.对该实验认识不正确的是C
所示装置可用来测定空气中氧气的含量.对该实验认识不正确的是C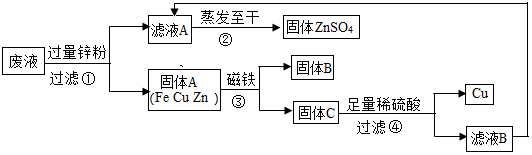 实验结束时,同学们将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,如果将废液直接排放就会造成水污染.于是几位同学利用课余处理废液,回收工业重要原料硫酸锌和有关金属.实验过程如图所示:
实验结束时,同学们将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,如果将废液直接排放就会造成水污染.于是几位同学利用课余处理废液,回收工业重要原料硫酸锌和有关金属.实验过程如图所示: