11.实验设计是化学实验的重要环节,请根据下列实验要求回答相关问题:
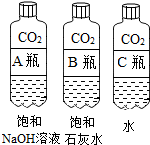
【活动与探究一】用对比实验方法探究二氧化碳的性质.
查阅资料:蓝色石蕊试纸遇酸变红
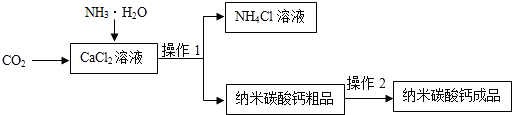
(1)实验一中振荡3个矿泉水塑料瓶,观察到塑料瓶变瘪的程度为A>B>C,其中变浑浊的瓶内发生反应的化学方程式为CO2+Ca(OH)2═CaCO3↓+H2O;对比A瓶与C(填“B”或“C”)瓶的实验现象,可证明CO2能与NaOH发生反应.
(2)实验二观察到C装置中发生的现象是湿润的蓝色石蕊试纸变红,结论是CO2+H2O═H2CO3(用化学方程式表示).
【活动与探究二】探究燃烧条件:若B处盛放木炭.
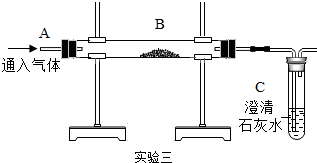
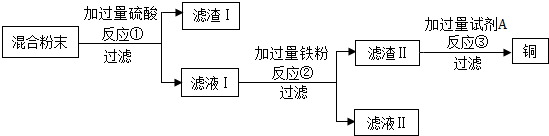
Ⅰ.先在A处通入氮气一段时间后,在B处加热,B、C处没有明显变化;
Ⅱ.待B处冷却至室温,在A处通入氧气一段时间后,B、C处没有明显变化;
Ⅲ.在A处继续通入氧气,然后在B处加热,发现木炭燃烧,C处变浑浊.
(3)Ⅰ与Ⅲ对比,说明燃烧的条件之一是氧气;Ⅱ与Ⅲ对比,说明燃烧的条件之一是温度达到着火点.
【活动与探究三】定量测定空气中氧气的含量.
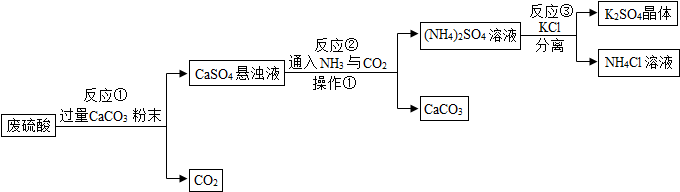
(4)实验四中,反应的原理为2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO(用化学方程式表示);
装置一比装置二更合理,理由是装置一中氧气反应的更充分;
根据如表提供的实验数据,完成如表:
定量实验操作中易产生误差,如果反应前气球中存在气体(其量小于注射器内的空气),而实验后冷却至室温,将气球内的气体全部挤出读数,导致实验测得结果偏小(填“偏小”、“偏大”或“无影响”).
【活动与探究一】用对比实验方法探究二氧化碳的性质.
查阅资料:蓝色石蕊试纸遇酸变红
| 实验一 | 实验二 |
 | 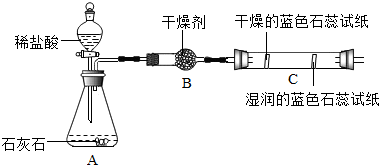 |
(2)实验二观察到C装置中发生的现象是湿润的蓝色石蕊试纸变红,结论是CO2+H2O═H2CO3(用化学方程式表示).
【活动与探究二】探究燃烧条件:若B处盛放木炭.

Ⅰ.先在A处通入氮气一段时间后,在B处加热,B、C处没有明显变化;
Ⅱ.待B处冷却至室温,在A处通入氧气一段时间后,B、C处没有明显变化;
Ⅲ.在A处继续通入氧气,然后在B处加热,发现木炭燃烧,C处变浑浊.
(3)Ⅰ与Ⅲ对比,说明燃烧的条件之一是氧气;Ⅱ与Ⅲ对比,说明燃烧的条件之一是温度达到着火点.
【活动与探究三】定量测定空气中氧气的含量.
| 实验四 | |
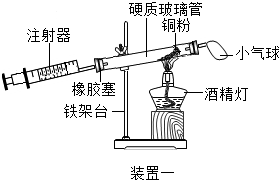 | 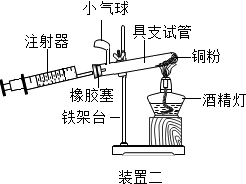 |
装置一比装置二更合理,理由是装置一中氧气反应的更充分;
根据如表提供的实验数据,完成如表:
| 硬质玻璃管中空气的体积 | 反应前注射器中空气体积 | 反应后注射器中气体体积 | 实验测得空气中氧气的体积分数 |
| 30mL | 20mL | 12mL | 16% |
7.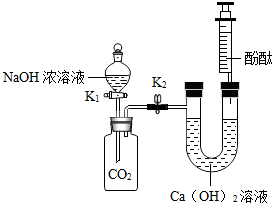 某化学兴趣小组在探究二氧化碳与氢氧化钠溶液反应的实验中,做了如图所示的实验:将足量的氢氧化钠浓溶液装入分液漏斗中,先打开阀门K1,待氢氧化钠溶液完全进入广口瓶之后立即关闭K1,充分反应后,打开止水夹K2.
某化学兴趣小组在探究二氧化碳与氢氧化钠溶液反应的实验中,做了如图所示的实验:将足量的氢氧化钠浓溶液装入分液漏斗中,先打开阀门K1,待氢氧化钠溶液完全进入广口瓶之后立即关闭K1,充分反应后,打开止水夹K2.
(1)请填写现象:U型管右侧液体变红.
(2)广口瓶中的液体出现浑浊.请写出广口瓶中出现浑浊现象的原因:CO2+2NaOH=Na2CO3+H2O;Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.(用化学方程式表示)
(3)同学们将实验后的废液倒入烧杯中,过滤得白色沉淀和红色滤液,欲对滤液的成分进行探究,设计如下实验方案,请你帮助他们完成探究报告:
(4)反思拓展:实验步骤①中所加的试剂可换成以下AB,也能通过观察现象得出同样的结论.
A.CaCl2溶液 B.Ba(OH)2溶液 C.NaCl溶液.
0 149277 149285 149291 149295 149301 149303 149307 149313 149315 149321 149327 149331 149333 149337 149343 149345 149351 149355 149357 149361 149363 149367 149369 149371 149372 149373 149375 149376 149377 149379 149381 149385 149387 149391 149393 149397 149403 149405 149411 149415 149417 149421 149427 149433 149435 149441 149445 149447 149453 149457 149463 149471 211419
 某化学兴趣小组在探究二氧化碳与氢氧化钠溶液反应的实验中,做了如图所示的实验:将足量的氢氧化钠浓溶液装入分液漏斗中,先打开阀门K1,待氢氧化钠溶液完全进入广口瓶之后立即关闭K1,充分反应后,打开止水夹K2.
某化学兴趣小组在探究二氧化碳与氢氧化钠溶液反应的实验中,做了如图所示的实验:将足量的氢氧化钠浓溶液装入分液漏斗中,先打开阀门K1,待氢氧化钠溶液完全进入广口瓶之后立即关闭K1,充分反应后,打开止水夹K2.(1)请填写现象:U型管右侧液体变红.
(2)广口瓶中的液体出现浑浊.请写出广口瓶中出现浑浊现象的原因:CO2+2NaOH=Na2CO3+H2O;Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.(用化学方程式表示)
(3)同学们将实验后的废液倒入烧杯中,过滤得白色沉淀和红色滤液,欲对滤液的成分进行探究,设计如下实验方案,请你帮助他们完成探究报告:
| 实 验 步 骤 | 实 验 现 象 | 实 验 结 论 |
| ①取滤液样品于试管中,加入足量的盐酸; | 若有气泡冒出,且红色消失 | 原废液中的溶质为: Na2CO3和NaOH; |
| ②另取滤液样品于试管中,加入Na2CO3溶液. | 若有白色沉淀出现,红色不消失 | 原废液中的溶质为: Ca(OH)2和NaOH. |
A.CaCl2溶液 B.Ba(OH)2溶液 C.NaCl溶液.