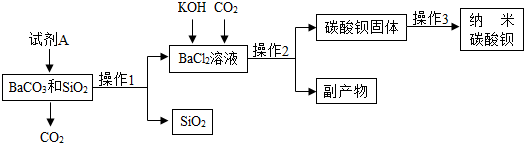
15.工业上常利石灰浆[主要成分为Ca(OH)2]制备化工原料KClO3和超细CaCO3.
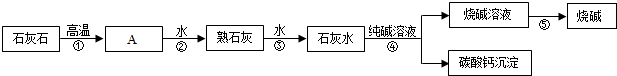
Ⅰ.制备KClO3的流程如图:

已知:①反应1为:6Cl2+6Ca(OH)2═Ca(ClO3)2+5CaCl2+6H2O.
②有关物质在常温下的溶解度如表:
(1)操作a的名称是过滤,在实验室中完成此操作需要的玻璃仪器有烧杯、玻璃棒、漏斗,该操作中玻璃棒的作用是引流.
(2)反应2为复分解反应,则溶液A中含有的溶质为CaCl2和KClO3(填化学式),你认为该反应能得到KClO3晶体的原因是氯酸钾在该温度下的溶解度小.
(3)洗涤KClO3晶体时,可选用下列BC洗涤剂(填字母编号).
A.KCl饱和溶液 B.冰水 C.饱和KClO3溶液
Ⅱ.制备超细CaCO3的流程如图已知NH4Cl溶液呈酸性.
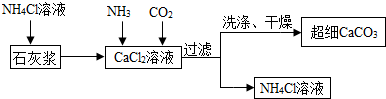
(1)向CaCl2溶液中通入两种气体,生成超细CaCO3的化学方程式CaCl2+2NH3+CO2+H2O=CaCO3↓+2NH4Cl.该流程可循环使用的物质是NH4Cl.
(2)检验CaCO3是否洗涤干净的方法是:取最后一次洗涤液,向其中滴加AB(填写序号),观察,根据实验现象推断是否洗干净.
A.Na2CO3溶液 B.AgNO3溶液 C.酚酞试液.
Ⅰ.制备KClO3的流程如图:

已知:①反应1为:6Cl2+6Ca(OH)2═Ca(ClO3)2+5CaCl2+6H2O.
②有关物质在常温下的溶解度如表:
| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| 溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
(2)反应2为复分解反应,则溶液A中含有的溶质为CaCl2和KClO3(填化学式),你认为该反应能得到KClO3晶体的原因是氯酸钾在该温度下的溶解度小.
(3)洗涤KClO3晶体时,可选用下列BC洗涤剂(填字母编号).
A.KCl饱和溶液 B.冰水 C.饱和KClO3溶液
Ⅱ.制备超细CaCO3的流程如图已知NH4Cl溶液呈酸性.

(1)向CaCl2溶液中通入两种气体,生成超细CaCO3的化学方程式CaCl2+2NH3+CO2+H2O=CaCO3↓+2NH4Cl.该流程可循环使用的物质是NH4Cl.
(2)检验CaCO3是否洗涤干净的方法是:取最后一次洗涤液,向其中滴加AB(填写序号),观察,根据实验现象推断是否洗干净.
A.Na2CO3溶液 B.AgNO3溶液 C.酚酞试液.
9.苯甲酸是一种食品防腐剂,它是一种片状晶体,在水中的溶解度如表:
某同学为了提纯某一苯甲酸样品(其中含泥沙等难溶于水的杂质),进行了如下实验:
(1)取样品约1g放入烧杯中,加入50mL蒸馏水充分搅拌,发现样品几乎没溶解,原因是常温下苯甲酸溶解度很小.
(2)将烧杯放在石棉网上加热,将样品充分溶解后,在加入少量蒸馏水,然后趁热过滤.趁热过滤的目的是减小过滤时苯甲酸的损失.
(3)将所得滤液缓慢降温至室温,使苯甲酸以晶体形式析出,然后过滤得到较纯净的苯甲酸晶体.
0 149251 149259 149265 149269 149275 149277 149281 149287 149289 149295 149301 149305 149307 149311 149317 149319 149325 149329 149331 149335 149337 149341 149343 149345 149346 149347 149349 149350 149351 149353 149355 149359 149361 149365 149367 149371 149377 149379 149385 149389 149391 149395 149401 149407 149409 149415 149419 149421 149427 149431 149437 149445 211419
| 温度℃ | 25 | 50 | 95 |
| 溶解度g | 0.17 | 0.95 | 6.8 |
(1)取样品约1g放入烧杯中,加入50mL蒸馏水充分搅拌,发现样品几乎没溶解,原因是常温下苯甲酸溶解度很小.
(2)将烧杯放在石棉网上加热,将样品充分溶解后,在加入少量蒸馏水,然后趁热过滤.趁热过滤的目的是减小过滤时苯甲酸的损失.
(3)将所得滤液缓慢降温至室温,使苯甲酸以晶体形式析出,然后过滤得到较纯净的苯甲酸晶体.