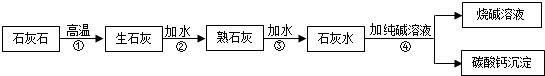
7. 某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下探究.
某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下探究.
老师提示:
I.电解饱和食盐水的化学方程式:
2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑
Ⅱ.忽略其他可能发生的反应对本实验的影响.
探究活动一:检验待测液中含有氢氧化钠
(1)同学们选用某种酸碱指示剂对待测液进行检验,请你将实验报告填写完整.
探究活动二:测定待测液中氢氧化钠的质量分数
【实验】用沉淀法测定
资料摘要:氢氧化钠与氯化镁在溶液中发生反应:
同学们按如图所示的实验步骤进行实验:
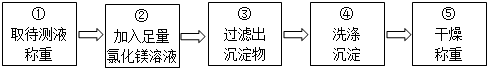
(2)步骤②加入的氯化镁溶液必需足量,其目的是使NaOH完全反应.步骤④中判断沉淀物是否洗净的具有操作:取最后一次洗涤液少许于试管中,滴加硝酸银溶液,若无白色沉淀生成,说明沉淀物已洗净,反之则没有洗净(写出实验步骤、现象和结论).
(3)步骤②中发生反应的化学方程式是2NaOH+MgCl2=Mg(OH)2↓+2NaCl.
(4)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,所测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).
 某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下探究.
某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下探究.老师提示:
I.电解饱和食盐水的化学方程式:
2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑
Ⅱ.忽略其他可能发生的反应对本实验的影响.
探究活动一:检验待测液中含有氢氧化钠
(1)同学们选用某种酸碱指示剂对待测液进行检验,请你将实验报告填写完整.
| 实验步骤 | 实验现象 | 实验结论 |
| 取样,滴加几滴无色酚酞试液 | 溶液变红色 | 待测液中含有氢氧化钠. |
【实验】用沉淀法测定
资料摘要:氢氧化钠与氯化镁在溶液中发生反应:
同学们按如图所示的实验步骤进行实验:

(2)步骤②加入的氯化镁溶液必需足量,其目的是使NaOH完全反应.步骤④中判断沉淀物是否洗净的具有操作:取最后一次洗涤液少许于试管中,滴加硝酸银溶液,若无白色沉淀生成,说明沉淀物已洗净,反之则没有洗净(写出实验步骤、现象和结论).
(3)步骤②中发生反应的化学方程式是2NaOH+MgCl2=Mg(OH)2↓+2NaCl.
(4)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,所测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).
5.某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验,向烧杯中的氢氧化钙溶液滴加一定量的稀盐酸后,发现忘记滴加指示剂,此时,他们停止滴加稀盐酸,并对烧杯内溶液中溶质的成分进行探究.
(1)写出该中和反应的化学方程式Ca(OH)2+2HCl=CaCl2+2H2O.
(2)探究烧杯内溶液中溶质的成分:
【作出猜想】(A)溶质可能是CaCl2与Ca(OH)2 (B)可能是CaCl2
(C)溶质可能是CaCl2与HCl
【查阅资料】CaCl2溶液呈中性
【实验设计】
①取少量烧杯中的溶液于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色.于是排除了猜想(A),你认为排除猜想(A)的理由是酚酞溶液不变色,说明溶液不呈碱性,而猜想A的溶液呈碱性,所以可以排除.
②小华想用碳酸钠溶液来验证后两种猜想,请你帮他完成实验,填写以下表格:
【交流反思】为确定猜想(C)正确,下列几种实验方案不合理的是D(填字母).
A.取反应后的溶液于试管中,滴加紫色石蕊试液变红色
B.取反应后的溶液于试管中,加入锌粉冒气泡
C.用洁净的玻璃棒蘸取反应后的溶液,涂抹在pH试纸上,测溶液的pH<7
D.取反应后的溶液于试管中,加入硝酸银溶液,生成白色沉淀.
(1)写出该中和反应的化学方程式Ca(OH)2+2HCl=CaCl2+2H2O.
(2)探究烧杯内溶液中溶质的成分:
【作出猜想】(A)溶质可能是CaCl2与Ca(OH)2 (B)可能是CaCl2
(C)溶质可能是CaCl2与HCl
【查阅资料】CaCl2溶液呈中性
【实验设计】
①取少量烧杯中的溶液于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色.于是排除了猜想(A),你认为排除猜想(A)的理由是酚酞溶液不变色,说明溶液不呈碱性,而猜想A的溶液呈碱性,所以可以排除.
②小华想用碳酸钠溶液来验证后两种猜想,请你帮他完成实验,填写以下表格:
| 实验步骤 | 预计现象 | 预计结论 |
| 取少量反应后的溶液于试管中, 逐滴加入碳酸钠溶液 | 生成白色沉淀 | 猜想(B)正确 |
| 先有气泡产生,后产生白色沉淀 | 猜想(C)正确 |
A.取反应后的溶液于试管中,滴加紫色石蕊试液变红色
B.取反应后的溶液于试管中,加入锌粉冒气泡
C.用洁净的玻璃棒蘸取反应后的溶液,涂抹在pH试纸上,测溶液的pH<7
D.取反应后的溶液于试管中,加入硝酸银溶液,生成白色沉淀.
3.FeCl3可用作催化剂和外伤止血剂.某实验兴趣小组利用FeCl3腐蚀电路铜板后的溶液(主要成分为FeCl2、CuCl2)进行了氯化铁回收实验.该实验小组同学通过查阅资料,进行了尝试.
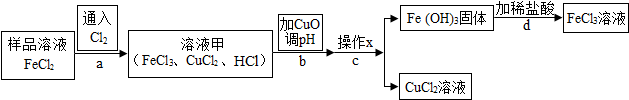
【阅读资料】
不同金属氢氧化物可以在不同pH范围内从溶液中沉淀析出,工业上利用调节溶液pH的方法,使金属氢氧化物依次沉淀,结合过滤等操作,进行物质分离.如表是氢氧化铁与氢氧化铜开始沉淀与沉淀完全的pH
(1)操作x是过滤.
(2)实验中,步骤b加入 CuO 消耗 溶液甲中的HCl,使溶液pH增大到所需范围,请写出盐酸与氧化铜反应的化学方程式CuO+2HCl=CuCl2+H2O;该反应属于复分解反应(填基本反应类型).你认为步骤b调节溶液的pH到3.2~4.7(填数值范围)比较合适.
(3)实验中,步骤d加稀盐酸前,因缺少洗涤(填操作名称)而使获得的氯化铁溶液不纯.
(4)FeCl3溶液容易生成Fe( OH ) 3 发 生变质,在保存FeCl3溶液时,常向FeCl3溶液中加入某种酸,以防止FeCl3溶液变质,你认为选用C(用字母表示)最合理.
A.稀硝酸 B.稀硫酸 C.稀盐酸 D.稀醋酸.
0 149200 149208 149214 149218 149224 149226 149230 149236 149238 149244 149250 149254 149256 149260 149266 149268 149274 149278 149280 149284 149286 149290 149292 149294 149295 149296 149298 149299 149300 149302 149304 149308 149310 149314 149316 149320 149326 149328 149334 149338 149340 149344 149350 149356 149358 149364 149368 149370 149376 149380 149386 149394 211419

【阅读资料】
| Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀的pH | 1.9 | 4.7 |
| 沉淀完全的pH | 3.2 | 6.7 |
(1)操作x是过滤.
(2)实验中,步骤b加入 CuO 消耗 溶液甲中的HCl,使溶液pH增大到所需范围,请写出盐酸与氧化铜反应的化学方程式CuO+2HCl=CuCl2+H2O;该反应属于复分解反应(填基本反应类型).你认为步骤b调节溶液的pH到3.2~4.7(填数值范围)比较合适.
(3)实验中,步骤d加稀盐酸前,因缺少洗涤(填操作名称)而使获得的氯化铁溶液不纯.
(4)FeCl3溶液容易生成Fe( OH ) 3 发 生变质,在保存FeCl3溶液时,常向FeCl3溶液中加入某种酸,以防止FeCl3溶液变质,你认为选用C(用字母表示)最合理.
A.稀硝酸 B.稀硫酸 C.稀盐酸 D.稀醋酸.