10.小明同学发现某视频的包装袋内有一个小纸袋,上面写着“视频保鲜剂”,他很好奇,想和同学们对“食品保鲜剂”的成分进行探究.
【发现问题】“食品保鲜剂”的成分是什么?
【查阅资料】a.食品保鲜剂是利用其中的有效成分吸收空气中的氧气和水蒸气,防止食品变质.
b.初中阶段学习过的能吸收氧气或水蒸气的物质有:①氢氧化钠 ②生石灰 ③铁粉 ④浓硫酸
【初步探究】同学们经过讨论,一致认为不可能是浓硫酸和氢氧化钠,理由是氢氧化钠和浓硫酸具有强烈的腐蚀性且浓硫酸是液体.
同学们打开小纸袋,发现袋内固体为白色,则该保鲜剂的有效成分一定不是铁粉.
【继续探究】同学们对袋内白色固体的成分继续探究:
【拓展应用】食品保鲜剂除了能够吸收氧气或水蒸气外,还应具备一些要求,如:无毒等(写一点)等.
【发现问题】“食品保鲜剂”的成分是什么?
【查阅资料】a.食品保鲜剂是利用其中的有效成分吸收空气中的氧气和水蒸气,防止食品变质.
b.初中阶段学习过的能吸收氧气或水蒸气的物质有:①氢氧化钠 ②生石灰 ③铁粉 ④浓硫酸
【初步探究】同学们经过讨论,一致认为不可能是浓硫酸和氢氧化钠,理由是氢氧化钠和浓硫酸具有强烈的腐蚀性且浓硫酸是液体.
同学们打开小纸袋,发现袋内固体为白色,则该保鲜剂的有效成分一定不是铁粉.
【继续探究】同学们对袋内白色固体的成分继续探究:
| 实验操作 | 实验现象 | 结论与解释 |
| 1.取样品放入盛有水的试管中,用温度计测量水温先后的情况 | 温度升高 | 白色固体中含有 氧化钙 |
| 2.取样品放入研钵,与硝酸铵一起研磨 | 有刺激性气味的气体产生 | 白色固体中含有氢氧化钙 |
| 3.取样滴加稀盐酸 | 有气体产生 | 白色固体中含有碳酸钙,产生该气体的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑. |
8.研究性学习小组选择“影响H2O2分解生成O2的速率的因素”为课题进行探究,以下是他们探究的主要过程.
【假设】H2O2生成OO2的快慢与反应物的浓度有关.
【实验方案】常温下,在两瓶相同质量、不同浓度的H2O2溶液中,分别加入相同质量的MnO2,测量各生成一瓶相同体积的 O2所需的时间.
【进行实验】略
【实验记录】
【结论】该探究过程得出的结论是在相同条件下,影响H2O2分解生成O2的速率与反应物的浓度有关;
【拓展】影响H2O2分解生成 O2的速率的因素还有哪些?请你帮助他们继续探究.(只要提出一种影响H2O2生成 O2的快慢的因素以及相关假设和实验方案).
【假设】催化剂的种类;
【实验方案】在同温下,取两份相同质量、相同浓度的H2O2溶液,分别加入质量相等的二氧化锰和红砖粉,测量各收集一瓶气体所需的时间.
【假设】H2O2生成OO2的快慢与反应物的浓度有关.
【实验方案】常温下,在两瓶相同质量、不同浓度的H2O2溶液中,分别加入相同质量的MnO2,测量各生成一瓶相同体积的 O2所需的时间.
【进行实验】略
【实验记录】
| 实验编号 | 1 | 2 |
| 反应物 | 5%H2O2溶液 | 10%H2O2溶液 |
| 催化剂 | 1gMnO2 | 1g MnO2 |
| 时间 | 50s | 21s |
【拓展】影响H2O2分解生成 O2的速率的因素还有哪些?请你帮助他们继续探究.(只要提出一种影响H2O2生成 O2的快慢的因素以及相关假设和实验方案).
【假设】催化剂的种类;
【实验方案】在同温下,取两份相同质量、相同浓度的H2O2溶液,分别加入质量相等的二氧化锰和红砖粉,测量各收集一瓶气体所需的时间.
7.环保石头纸的主要成分为碳酸钙,加入适量聚乙烯和少量胶合剂.
【实验一】探究影响石头纸与盐酸反应快慢的因素
(3)甲、乙两同学设计实验如表:
【实验二】测定石头纸中碳酸钙的质量分数提示:石头纸中其他成分均不与盐酸反应,也不溶于水.
(2)甲组同学:图Ⅰ为石头纸与稀盐酸反应的装置,图Ⅱ用于测量通常状况下CO2的体积.

①实验前首先要;②图Ⅱ装置中油层的作用是;③反应完成后,先调节量气管高度,使两侧液面相平(填具体操作),然后才能准确读得量气管中的CO2的体积.
④根据VCO2和ρCO2计算出CO2的质量,计算碳酸钙质量.
(3)乙组同学:均匀称取四份样品分别和稀盐酸反应,用电子天平及有关装置,得出二氧化碳质量,实验数据记录如下表.
通过对数据的分析和比较,回答下列有关问题
①在第3份样品的实验中,样品中碳酸钙完全反应了;②m的值为2.20.
【实验一】探究影响石头纸与盐酸反应快慢的因素
(3)甲、乙两同学设计实验如表:
| 甲 | 乙 | |
| 实验过程 |  |  |
| 现象 | 试管①、②、③中产生气泡快慢的顺序为:①>②>③. | |
| 分析结论 | Ⅰ碳酸钙与稀盐酸反应的化学方程式为CaCO3+2HCl=CaCl2+CO2↑+H2O;Ⅱ对比甲同学实验①②可知,化学反应的速度越快; 和. Ⅲ对比甲同学实验(填实验序号)可知,反应物的接触面积越大,反应速率越. Ⅳ乙同学的实验中,应该连续记录的实验数据是 | |
(2)甲组同学:图Ⅰ为石头纸与稀盐酸反应的装置,图Ⅱ用于测量通常状况下CO2的体积.

①实验前首先要;②图Ⅱ装置中油层的作用是;③反应完成后,先调节量气管高度,使两侧液面相平(填具体操作),然后才能准确读得量气管中的CO2的体积.
④根据VCO2和ρCO2计算出CO2的质量,计算碳酸钙质量.
(3)乙组同学:均匀称取四份样品分别和稀盐酸反应,用电子天平及有关装置,得出二氧化碳质量,实验数据记录如下表.
| 第1份 | 第2份 | 第3份 | 第4份 | |
| 取样品质量(g) | 6.25 | 6.25 | 6.25 | 6.25 |
| 取稀盐酸的体积(mL) | 10.0 | 20.0 | 30.0 | 40.0 |
| 产生气体的质量(g) | 0.88 | 1.76 | 2.20 | m |
①在第3份样品的实验中,样品中碳酸钙完全反应了;②m的值为2.20.
6.某兴趣小组对“铁锈(Fe2O3)与盐酸反应快慢的影响因素”进行了探究.
【提出问题】铁锈与盐酸反应的快慢受哪些因速的影响呢?
【猜想与假设】a.可能与盐酸的质量分数有关;
b.可能与反应的温度有关.
【设计实验】用相同质量的铁锈和足量的盐酸进行如表实验.
(1)写出铁锈与盐酸反应的化学方程式Fe2O3+6HCl═2FeCl3+3H2O.
(2)要比较温度对反应快慢的影响,应选择的实验编号是②③.
【得出结论】(3)从以上实验中可得出的结论是①温度越高,反应时间越短,反应速率越快;②酸的溶质质量分数越大,反应速率越快.
【实验拓展】(4)随后在铁锈与盐酸反应的试管中加入少量硫酸,发现反应明显加快,可能是硫酸中H+(填化学符号)加快了反应的速率,请设计一个合理的实验来验证你的假设在铁锈与盐酸反应的试管中加入少量硫酸钠溶液,发现反应速率没有改变,说明不是其中的硫酸根离子所起的作用.
(5)铁锈与盐酸反应的快慢可能还受哪些因速影响?设计实验验证.
0 149075 149083 149089 149093 149099 149101 149105 149111 149113 149119 149125 149129 149131 149135 149141 149143 149149 149153 149155 149159 149161 149165 149167 149169 149170 149171 149173 149174 149175 149177 149179 149183 149185 149189 149191 149195 149201 149203 149209 149213 149215 149219 149225 149231 149233 149239 149243 149245 149251 149255 149261 149269 211419
【提出问题】铁锈与盐酸反应的快慢受哪些因速的影响呢?
【猜想与假设】a.可能与盐酸的质量分数有关;
b.可能与反应的温度有关.
【设计实验】用相同质量的铁锈和足量的盐酸进行如表实验.
| 实验编号 | 盐酸的质量分数 | 反应的速度 | 铁锈消失的时间 |
| ① | 6% | 20℃ | 240 s |
| ② | 10% | 20℃ | 115 s |
| ③ | 10% | 30℃ | 75 s |
(2)要比较温度对反应快慢的影响,应选择的实验编号是②③.
【得出结论】(3)从以上实验中可得出的结论是①温度越高,反应时间越短,反应速率越快;②酸的溶质质量分数越大,反应速率越快.
【实验拓展】(4)随后在铁锈与盐酸反应的试管中加入少量硫酸,发现反应明显加快,可能是硫酸中H+(填化学符号)加快了反应的速率,请设计一个合理的实验来验证你的假设在铁锈与盐酸反应的试管中加入少量硫酸钠溶液,发现反应速率没有改变,说明不是其中的硫酸根离子所起的作用.
(5)铁锈与盐酸反应的快慢可能还受哪些因速影响?设计实验验证.




 如图表示的是物质A~G相互间的关系“→”表示物质间存在的转化关系,“-”表示两端的物质能发生化学反应).相关信息如下:A、F都是单质,F是使用最多的金属材料,B是导致温室效应的主要气体之一,C在工业上广泛用于玻璃、造纸和洗涤剂的生产等,E是一种蓝色溶液.
如图表示的是物质A~G相互间的关系“→”表示物质间存在的转化关系,“-”表示两端的物质能发生化学反应).相关信息如下:A、F都是单质,F是使用最多的金属材料,B是导致温室效应的主要气体之一,C在工业上广泛用于玻璃、造纸和洗涤剂的生产等,E是一种蓝色溶液.
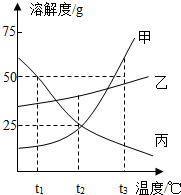 如图是甲、乙、丙三种物质的溶解度曲线.
如图是甲、乙、丙三种物质的溶解度曲线. A、B、C、D均含有同一种元素,它们的转化关系如图(部分物质和反应条件已略去):
A、B、C、D均含有同一种元素,它们的转化关系如图(部分物质和反应条件已略去):