17.下列做法不能达到实验目的是( )
| A. | 区别黄金和黄铜:稀盐酸 | |
| B. | 除去二氧化碳中的氯化氢气体:澄清石灰水 | |
| C. | 区别硝酸铵和生石灰:水 | |
| D. | 区别水和过氧化氢溶液:二氧化锰 |
16.下列关于溶液的说法,不正确的是( )
| A. | 向某固体中加入稀盐酸,产生无色气体,则原固体中一定含CO32- | |
| B. | 汗水浸湿的衣服晾干后出现白色斑迹,是因为水分蒸发后盐分结晶析出 | |
| C. | 氨水是氨气的水溶液,根据气体溶解度变化规律,贮存时要阴凉密封 | |
| D. | 氯化钠在20℃时溶解度是36g,则20℃时的136g的氯化钠饱和溶液中含有氯化钠36g |
13.某研究小组探究影响过氧化氢分解速率的因素进行了如下实验.记录了各实验的数据如表:
实验一
(1)通过实验①和②对比可知,化学反应速率与反应物浓度有关;从实验③和④对比可知,化学反应速率与温度的关系是温度越高,化学反应速率越快;
(2)用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总质量不变(选填“减小”或“不变”或“增大”).
资料信息:聪敏同学在网上查阅资料得知:Cu2+、Fe3+对H2O2分解也具有催化作用.
实验二
为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:
(3)定性分析:如图甲可通过观察反应产生气泡的快慢,定性比较得出结论.
有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是控制阴离子相同,排除阴离子的干扰.
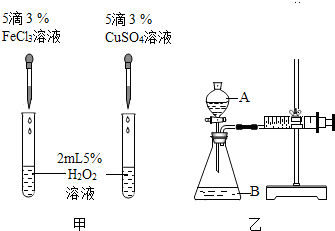
(4)定量分析:如图乙所示进行实验,在装药品前应该检查装置的气密性,具体做法是:将注射器活塞向外拉出一段,松开手一会儿后,若活塞又回到原位,证明装置气密性良好,若实验时均以生成30mL气体为准,其他可能影响实验的因素均已忽略,实验中需要测量的数据是收集30mL气体所需要的时间.
(5)写出图甲任一反应的化学方程式:2H2O2$\frac{\underline{\;FeCl_{3}\;}}{\;}$2H2O+O2↑.
实验一
| 实验序号 | 过氧化氢溶液浓度、% | 过氧化氢溶液体积/ml | 温度/C | 二氧化锰的用量/g | 收集氧气的体积/ml | 反应所需的时间/s |
| 1 | 5 | 1 | 20 | 0.1 | 4 | 16.74 |
| 2 | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| 3 | 30 | 5 | 35 | 2 | 49.21 | |
| 4 | 30 | 5 | 55 | 2 | 10.76 |
(2)用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总质量不变(选填“减小”或“不变”或“增大”).
资料信息:聪敏同学在网上查阅资料得知:Cu2+、Fe3+对H2O2分解也具有催化作用.
实验二
为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:
(3)定性分析:如图甲可通过观察反应产生气泡的快慢,定性比较得出结论.
有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是控制阴离子相同,排除阴离子的干扰.

(4)定量分析:如图乙所示进行实验,在装药品前应该检查装置的气密性,具体做法是:将注射器活塞向外拉出一段,松开手一会儿后,若活塞又回到原位,证明装置气密性良好,若实验时均以生成30mL气体为准,其他可能影响实验的因素均已忽略,实验中需要测量的数据是收集30mL气体所需要的时间.
(5)写出图甲任一反应的化学方程式:2H2O2$\frac{\underline{\;FeCl_{3}\;}}{\;}$2H2O+O2↑.
11.下列各组符号中均既有宏观意义又有微观意义的一组是( )
| A. | H2、2H | B. | O2-、2O2 | C. | 2H、O2 | D. | H、O2 |
10.如图所示的集气瓶中装有排水法收集的某气体,据此判断与这种气体有关的物理性质是( )


| A. | 无色气体 | B. | 不易溶于水,密度比空气小 | ||
| C. | 密度比空气大,不易溶于水 | D. | 易溶于水,密度比空气大 |
9.氢气是未来的理想能源,科学家正在探索光分解水制取氢气反应的催化剂.下列有关说法正确的是( )
0 149035 149043 149049 149053 149059 149061 149065 149071 149073 149079 149085 149089 149091 149095 149101 149103 149109 149113 149115 149119 149121 149125 149127 149129 149130 149131 149133 149134 149135 149137 149139 149143 149145 149149 149151 149155 149161 149163 149169 149173 149175 149179 149185 149191 149193 149199 149203 149205 149211 149215 149221 149229 211419
| A. | 通过电解水实验可得出水由氢分子和氧分子构成 | |
| B. | 氢气在空气中点燃一定会发生爆炸 | |
| C. | 寻找催化剂的目的是加快光分解水的反应速率 | |
| D. | 检验氢气纯度时,听到尖锐爆鸣声,则证明氢气纯净了 |


