18. 小丽喜食豆腐,今天,小丽让妈妈为她做菠菜炒豆腐,可小丽的妈妈却告诉她菠菜不能与豆腐同食.
小丽喜食豆腐,今天,小丽让妈妈为她做菠菜炒豆腐,可小丽的妈妈却告诉她菠菜不能与豆腐同食.
【提出问题】菠菜为什么不能与豆腐同食?
【查阅资料】草酸钙(CaC2O4)是不能被人体吸收的沉积物.豆腐中含有较多的钙盐 如硫酸钙(CaSO4)等,菠菜、洋葱、竹笋中含有丰富的草酸(H2C2O4)、草酸钠(Na2C2O4),豆腐和上述几种蔬菜混合食用,可能诱发“结石”症.
(1)由草酸的化学式可知草酸由C、H、O三种元素组成.
(2)草酸与硫酸钙反应的化学方程式为H2C2O4+CaSO4?CaC2O4↓+H2SO4,请写出草酸钠与硫酸钙反应的化学方程式:Na2C2O4+CaSO4═Na2SO4+CaC2O4↓.
【提出猜想】菠菜与豆腐同食可能会诱发“结石”症.
【设计实验】
【发现新问题】被溶解的沉淀是什么?产生的气体又是什么?于是她又设计如下实验进一步探究:
已知草酸分解的化学方程式为:H2C2O4$\stackrel{187℃}{→}$H2O+CO2↑+CO↑
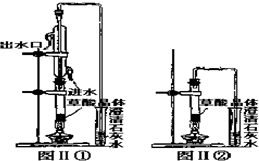
利用图Ⅱ①和图Ⅱ②加热草酸晶体,以验证草酸受热是否分解.连续加热一段时间后的现象是:图Ⅱ①:试管里澄清石灰水先变浑浊,后又变澄清,其原因CaCO3+H2O+CO2═Ca(HCO3)2;图Ⅱ②:试管里澄灰水只变浑浊其原因是草酸气体与石灰水反应生成草酸钙;能验证草酸受热分解的装置是1(填图Ⅱ中的编号“①”或“②”),理由是:因为①中有冷却装置(从装置的特点分析).
 小丽喜食豆腐,今天,小丽让妈妈为她做菠菜炒豆腐,可小丽的妈妈却告诉她菠菜不能与豆腐同食.
小丽喜食豆腐,今天,小丽让妈妈为她做菠菜炒豆腐,可小丽的妈妈却告诉她菠菜不能与豆腐同食.【提出问题】菠菜为什么不能与豆腐同食?
【查阅资料】草酸钙(CaC2O4)是不能被人体吸收的沉积物.豆腐中含有较多的钙盐 如硫酸钙(CaSO4)等,菠菜、洋葱、竹笋中含有丰富的草酸(H2C2O4)、草酸钠(Na2C2O4),豆腐和上述几种蔬菜混合食用,可能诱发“结石”症.
(1)由草酸的化学式可知草酸由C、H、O三种元素组成.
(2)草酸与硫酸钙反应的化学方程式为H2C2O4+CaSO4?CaC2O4↓+H2SO4,请写出草酸钠与硫酸钙反应的化学方程式:Na2C2O4+CaSO4═Na2SO4+CaC2O4↓.
【提出猜想】菠菜与豆腐同食可能会诱发“结石”症.
【设计实验】
| 实验步骤 | 实验现象 | 实验结论 |
| ①将菠菜在少量开水中煮沸2min~3min,取1mL~2mL滤液于试管中,丙滴加少量CaSO4或CaCl2溶液 | 产生白色沉淀 | 有草酸钙生成 |
| ②在步骤①的沉淀物中加入过量稀盐酸 | 沉淀部分溶解且产生气泡 | 被溶解的沉淀一定不是CaC2O4 |
| 实验步骤 | 实验现象 | 实验结论 |
| ③将步骤②产生的气体通入澄清的石灰水中 | 澄清的石灰水变浑浊 | 产生的气体是CO2步骤②被溶解的沉淀是碳酸钙 |
利用图Ⅱ①和图Ⅱ②加热草酸晶体,以验证草酸受热是否分解.连续加热一段时间后的现象是:图Ⅱ①:试管里澄清石灰水先变浑浊,后又变澄清,其原因CaCO3+H2O+CO2═Ca(HCO3)2;图Ⅱ②:试管里澄灰水只变浑浊其原因是草酸气体与石灰水反应生成草酸钙;能验证草酸受热分解的装置是1(填图Ⅱ中的编号“①”或“②”),理由是:因为①中有冷却装置(从装置的特点分析).
17. 某组同学在学习盐的性质时,将碳酸钠溶液和一瓶标签破损的溶液M(如图)进行反应,有白色沉淀产生,过滤后得到澄清滤液.同学们对该实验进行了一系列的探究.
某组同学在学习盐的性质时,将碳酸钠溶液和一瓶标签破损的溶液M(如图)进行反应,有白色沉淀产生,过滤后得到澄清滤液.同学们对该实验进行了一系列的探究.
探究一:M溶液中的溶质是什么?
(1)【提出猜想】该组同学认为M溶液的溶质有两种可能:①是Ca(OH)2,②是CaCl2
【收集资料】CaCl2水溶液呈中性.
(2)【设计实验】同学们设计了如下方案并进行实验:
请写出碳酸钠与溶液M反应的化学方程式Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
探究二 过滤后澄清滤液中会有哪些溶质?
【提出猜想】猜想一:NaOH和Na2CO3;猜想二:NaOH和Ca(OH)2;猜想三:NaOH
(3)【实验验证】同学们针对“猜想一”进行了如下实验:
他们的实验结论是否正确?否,理由是加入的(少量)盐酸先与溶液中的氢氧化钠反应,即使溶液中有碳酸钠,也可能不产生气体.
(4)【继续探究】设计实验方案确定滤液中溶质的组成.
(5)【反思与拓展】
在分析反应后所得溶液中溶质时,除考虑可溶性的生成物,还应考虑反应物是否有剩余.
0 148829 148837 148843 148847 148853 148855 148859 148865 148867 148873 148879 148883 148885 148889 148895 148897 148903 148907 148909 148913 148915 148919 148921 148923 148924 148925 148927 148928 148929 148931 148933 148937 148939 148943 148945 148949 148955 148957 148963 148967 148969 148973 148979 148985 148987 148993 148997 148999 149005 149009 149015 149023 211419
 某组同学在学习盐的性质时,将碳酸钠溶液和一瓶标签破损的溶液M(如图)进行反应,有白色沉淀产生,过滤后得到澄清滤液.同学们对该实验进行了一系列的探究.
某组同学在学习盐的性质时,将碳酸钠溶液和一瓶标签破损的溶液M(如图)进行反应,有白色沉淀产生,过滤后得到澄清滤液.同学们对该实验进行了一系列的探究.探究一:M溶液中的溶质是什么?
(1)【提出猜想】该组同学认为M溶液的溶质有两种可能:①是Ca(OH)2,②是CaCl2
【收集资料】CaCl2水溶液呈中性.
(2)【设计实验】同学们设计了如下方案并进行实验:
| 实验操作 | 实验现象 | 实验结论 |
| 取少量M溶液于试管中,向其中滴加无色酚酞试液 | 溶液变红色 | 猜想①正确. |
探究二 过滤后澄清滤液中会有哪些溶质?
【提出猜想】猜想一:NaOH和Na2CO3;猜想二:NaOH和Ca(OH)2;猜想三:NaOH
(3)【实验验证】同学们针对“猜想一”进行了如下实验:
| 实验操作 | 实验现象 | 实验结论 |
| 取样于试管中,滴入几滴稀盐酸 | 没有气体产生 | “猜想一”不成立 |
(4)【继续探究】设计实验方案确定滤液中溶质的组成.
| 实验操作 | 实验现象 | 实验结论 |
分别取少量滤液于A、B两支试管中,A中加入CaCl2溶液, B中加入Na2CO3溶液 | 若A中产生白色沉淀,B中没有沉淀 | “猜想一”成立 |
若A中没有沉淀,B中产生白色沉淀 | “猜想二”成立 | |
若A、B两支试管中都没有沉淀产生 | “猜想三”成立 |
在分析反应后所得溶液中溶质时,除考虑可溶性的生成物,还应考虑反应物是否有剩余.

 在生活和化学实验中,人们经常用到各种除湿剂(即干燥剂).
在生活和化学实验中,人们经常用到各种除湿剂(即干燥剂).

 初中化学中我们学习了二氧化碳的性质,二氧化硫与二氧化碳均属于非金属氧化物,是否具有相似的化学性质呢?
初中化学中我们学习了二氧化碳的性质,二氧化硫与二氧化碳均属于非金属氧化物,是否具有相似的化学性质呢?

