4.夏天到了,衣服上常会留下难以清洗的汗渍,果汁渍等.某校“我与化学”兴趣小组对“污渍爆炸盐”(一种新型衣物助洗剂)化学成分进行探究.主要探究过程如下:
(1)阅读产品标签:“主要成分是过氧碳酸钠,能在瞬间去除洗衣粉难以除去的多重顽固污渍…,本产品不伤衣物,‘无磷’是它的一大优点”.含磷洗涤剂对环境的危害是导致水体富营养化,产生水华现象.
(2)查阅资料:过氧碳酸钠(Na2CO4),白色结晶颗粒,其溶于水会产生碳酸盐和其他化合物.
(3)合理猜想:①其化合物为NaOH;②其化合物为H2O2;③其化合物为NaOH 和H2O2;该小组同学做出以上猜想的理论依据是根据质量守恒定律,化学反应前后元素的种类不变.
(4)实验设计:探究“污渍爆炸盐”水溶液的成份,完成下列表格.
限选试剂:稀盐酸、BaCl2 溶液、MgCl2 溶液、MnO2、蒸馏水
(1)阅读产品标签:“主要成分是过氧碳酸钠,能在瞬间去除洗衣粉难以除去的多重顽固污渍…,本产品不伤衣物,‘无磷’是它的一大优点”.含磷洗涤剂对环境的危害是导致水体富营养化,产生水华现象.
(2)查阅资料:过氧碳酸钠(Na2CO4),白色结晶颗粒,其溶于水会产生碳酸盐和其他化合物.
(3)合理猜想:①其化合物为NaOH;②其化合物为H2O2;③其化合物为NaOH 和H2O2;该小组同学做出以上猜想的理论依据是根据质量守恒定律,化学反应前后元素的种类不变.
(4)实验设计:探究“污渍爆炸盐”水溶液的成份,完成下列表格.
限选试剂:稀盐酸、BaCl2 溶液、MgCl2 溶液、MnO2、蒸馏水
| 实验步骤 | 实验现象 | 实验结论 |
| 步骤1:取少量“污渍爆炸盐”于烧杯中,加入足量蒸馏水,充分搅拌 | 固体完全溶解,形成无色溶液 |  |
| 步骤2:取少量步骤1形成的溶液与试管中,再滴加过量BaCl2溶液,震荡,静置 | 产生白色沉淀 | 含有Na2CO3 |
| 步骤3:取少量步骤2试管中的上层溶液与另一支试管中,再滴加少量MgCI2溶液,震荡 | 无明显现象 | 不含NaOH |
| 步骤4:另取一支试管,加入少量步骤1形成的溶液,再加入少量MnO2,将带火星木条伸入试管中 | 溶液中有气泡产生,带火星木条复燃 | 含有H2O2 |
3.南南同学看到“好想你”红枣袋中装有一袋防腐剂,品名为504双吸剂”,其标签如图1所示.南南和北北对这包久置的“504双吸剂”固体样品很好奇,设计如下实验进行探究.

[提出问题]久置固体的成分是什么?
[查阅资料]铁与氯化铁溶液在常温下发生反应生成氯化亚铁.
[作出猜想]久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3.
[实验探究]南南同学的方案:
北北同学认为南南同学的实验并不能得出一定不含Fe2O3的结论,理由是氧化铁和盐酸反应生成氯化铁,铁和氯化铁反应生成氯化亚铁,溶液也是浅绿色,并设计如图2实验方案继续验证.
(1)步骤②中固体溶解时放出大量热,则残留固体中一定有CaO.
(2)步骤③中反应的化学方程式是Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
北北同学对滤渣B又进行探究.
[实验结论]综合上述实验及所给数据,该久置固体中一定含有的物质是Fe、Fe2O3、CaO、CaCO3.

[提出问题]久置固体的成分是什么?
[查阅资料]铁与氯化铁溶液在常温下发生反应生成氯化亚铁.
[作出猜想]久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3.
[实验探究]南南同学的方案:
| 实验操作 | 实验现象 | 实验结论 |
| 取少量固体放于试管中,滴加足量的稀盐酸. | 固体逐渐消失,有无色气体产生,得到浅绿色溶液. | 固体中一定含有Fe, 一定不含Fe2O3. |
(1)步骤②中固体溶解时放出大量热,则残留固体中一定有CaO.
(2)步骤③中反应的化学方程式是Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
北北同学对滤渣B又进行探究.
| 实验操作 | 实验现象 | 实验结论 |
| ①取滤渣B于试管中,加入适量稀盐酸 ②生成的气体通入澄清石灰水) | ①有气泡冒出,溶液变为黄色 ②该溶液变浑浊. | 固体中一定含有CaCO3 和Fe2O3. |
1.锌及其氧化物(ZnO,白色,难溶于水,溶于强酸)具有广泛的应用.
(一)锌的广泛应用
(1)锌被称之为“生命元素”.儿童、青少年如果缺锌严重,将会导致“侏儒 症”和智力发育不良.经常吃贝壳类海产品、红色肉类等含锌的食物有利补“锌”.这里的“锌”是指B.
A.单质 B.元素 C.原子 D.分子
(2)实验室用锌与稀硫酸制取氢气,反应的化学方程式为Zn+H2SO4═ZnSO4+H2↑.
(3)锌与铜熔合可形成“黄铜”,它属于A(选填序号).
A.金属材料 B.无机非金属材料 C.合成材料 D.复合材料
(二)活性ZnO制取的探究
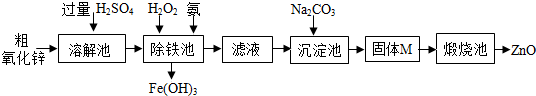
【实验方案】工业上用粗氧化锌(含少量FeO)制取活性氧化锌,其流程如下:
【查阅资料】一些阳离子以氢氧化物形式开始沉淀、完全沉淀时溶液的pH见上表.
【问题探究】
(4)“溶解”前将粗氧化锌粉碎成细颗粒,目的是增大接触面积,使其充分反应.
(5)“溶解”后得到的酸性溶液中含有ZnSO4、H2SO4、FeSO4.除铁池中加入适量H2O2,使Fe2+转化为Fe3+;为使溶液中Fe3+全部转化为Fe(OH)3,而Zn2+不形成Zn(OH)2,则应加入氨水控制溶液的pH的范围为1.5~3.2.
(6)“沉淀池”中的沉淀经过滤、洗涤等操作得纯净固体M,其组成为:aZnCO3•bZn(OH)2•cH2O.
确认固体M已经洗涤干净的操作是:取最后一次洗涤液,最好选择下列C,
向其中滴入无现象,则已经洗干净.
A.紫色石蕊试液 B.少量稀盐酸 C.氯化钡溶液或硝酸钡溶液空气
组成测定固体B的组成会影响制得的ZnO的活性.为确定aZnCO3•bZn(OH)2•cH2O的组成,进行如下实验(假设每步反应、吸收均完全):
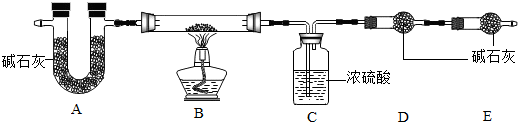
【查阅资料】aZnCO3•bZn(OH)2•cH2O受热分解生成ZnO、H2O、CO2三种产物.
(7)写出装置B中发生反应的化学方程式aZnCO3•bZn(OH)2•cH2O$\frac{\underline{\;\;△\;\;}}{\;}$(a+b)ZnO+(b+c)H2O+aCO2↑.
ZHEN现称取35.9g aZnCO3•bZn(OH)2•cH2O在B装置中进行完全煅烧,测得装置C和D的质量分别增重7.2g和4.4g.
【实验分析及数据处理】
(8)装置A的作用是除去空气中的H2O和CO2.
(9)根据上述数据,则生成ZnO的质量为24.3g;a:b:c=1:2:2.
(10)若没有E装置,则测得的a值偏大(填“偏大”、“偏小”或“不变”).
0 148359 148367 148373 148377 148383 148385 148389 148395 148397 148403 148409 148413 148415 148419 148425 148427 148433 148437 148439 148443 148445 148449 148451 148453 148454 148455 148457 148458 148459 148461 148463 148467 148469 148473 148475 148479 148485 148487 148493 148497 148499 148503 148509 148515 148517 148523 148527 148529 148535 148539 148545 148553 211419
(一)锌的广泛应用
(1)锌被称之为“生命元素”.儿童、青少年如果缺锌严重,将会导致“侏儒 症”和智力发育不良.经常吃贝壳类海产品、红色肉类等含锌的食物有利补“锌”.这里的“锌”是指B.
A.单质 B.元素 C.原子 D.分子
(2)实验室用锌与稀硫酸制取氢气,反应的化学方程式为Zn+H2SO4═ZnSO4+H2↑.
(3)锌与铜熔合可形成“黄铜”,它属于A(选填序号).
A.金属材料 B.无机非金属材料 C.合成材料 D.复合材料
(二)活性ZnO制取的探究
【实验方案】工业上用粗氧化锌(含少量FeO)制取活性氧化锌,其流程如下:

| 沉淀物 | Fe(OH)3 | Zn(OH)2 | Fe(OH)2 |
| 开始沉淀pH | 1.5 | 6.2 | 6.3 |
| 完全沉淀pH | 3.2 | 8.0 | 9.7 |
【问题探究】
(4)“溶解”前将粗氧化锌粉碎成细颗粒,目的是增大接触面积,使其充分反应.
(5)“溶解”后得到的酸性溶液中含有ZnSO4、H2SO4、FeSO4.除铁池中加入适量H2O2,使Fe2+转化为Fe3+;为使溶液中Fe3+全部转化为Fe(OH)3,而Zn2+不形成Zn(OH)2,则应加入氨水控制溶液的pH的范围为1.5~3.2.
(6)“沉淀池”中的沉淀经过滤、洗涤等操作得纯净固体M,其组成为:aZnCO3•bZn(OH)2•cH2O.
确认固体M已经洗涤干净的操作是:取最后一次洗涤液,最好选择下列C,
向其中滴入无现象,则已经洗干净.
A.紫色石蕊试液 B.少量稀盐酸 C.氯化钡溶液或硝酸钡溶液空气
组成测定固体B的组成会影响制得的ZnO的活性.为确定aZnCO3•bZn(OH)2•cH2O的组成,进行如下实验(假设每步反应、吸收均完全):

【查阅资料】aZnCO3•bZn(OH)2•cH2O受热分解生成ZnO、H2O、CO2三种产物.
(7)写出装置B中发生反应的化学方程式aZnCO3•bZn(OH)2•cH2O$\frac{\underline{\;\;△\;\;}}{\;}$(a+b)ZnO+(b+c)H2O+aCO2↑.
ZHEN现称取35.9g aZnCO3•bZn(OH)2•cH2O在B装置中进行完全煅烧,测得装置C和D的质量分别增重7.2g和4.4g.
【实验分析及数据处理】
(8)装置A的作用是除去空气中的H2O和CO2.
(9)根据上述数据,则生成ZnO的质量为24.3g;a:b:c=1:2:2.
(10)若没有E装置,则测得的a值偏大(填“偏大”、“偏小”或“不变”).

 ”为铜片):
”为铜片):

 ,②所示元素的单质的化学式是Cl2
,②所示元素的单质的化学式是Cl2