5. 如图是a、b、c三种物质的溶解度曲线.下列说法不正确的是( )
如图是a、b、c三种物质的溶解度曲线.下列说法不正确的是( )
 如图是a、b、c三种物质的溶解度曲线.下列说法不正确的是( )
如图是a、b、c三种物质的溶解度曲线.下列说法不正确的是( )| A. | P点表示t1℃时,a、c两种物质的溶解度相等 | |
| B. | 将c的饱和溶液变为不饱和溶液,可采用降温的方法 | |
| C. | t2℃时,将30ga物质加入到50g水中充分搅拌,得到75ga的饱和溶液 | |
| D. | 将t1℃时,a、b、c三种物质的饱和溶液升温至t2℃,其溶质质量分数由大到小的顺序是a>b>c |
3.向一定质量的AgNO3和Cu(NO3)2的混合溶液中加入ngZn,充分反映后过滤,将滤渣洗涤、干燥后再称量,得到的质量为ng,据此,下列说法正确的是( )
| A. | 滤渣中的物质至少有两种 | |
| B. | 取反应后的滤液滴加稀盐酸,有白色沉淀产生 | |
| C. | 取滤渣滴加稀硫酸,一定有气泡产生 | |
| D. | 取反应后的滤液观察,滤液不可能呈蓝色 |
2.某化学兴趣小组围绕“酸碱中和反应”,在老师引导下开展探究活动.
探究Ⅰ:证明氢氧化钠溶液与稀盐酸确实能发生反应.
【方案1】测定稀盐酸与NaOH溶液混合前后的pH.
测定某NaOH溶液的pH,pH大于7.将一定量的稀盐酸加入该NaOH溶液中,混合均匀后测定其pH,发现pH减小了,但仍然大于7,小组中有的同学认为根据这个测定结果可以认为稀盐酸与NaOH溶液发生了反应,你认为他们的结论是否正确:不正确,理由滴加的盐酸中含水,加入后使NaOH溶液变稀,同样会使溶液碱性减弱,pH减小.经过讨论后,他们向溶液中又加入一定量的稀盐酸,混合均匀后测定其pH,pH小于7.
结论:稀盐酸与氢氧化钠溶液发生了化学反应,并且稀盐酸过量.
【方案2】借助于无色酚酞试液.
【药品仪器】(如图1)
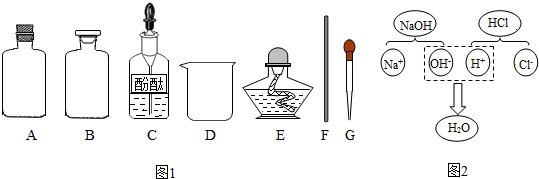
①取A(选填“A”或“B”)中试剂加入至D中,滴加2滴酚酞试液,溶液呈红色;
②用胶头滴管向①中溶液滴加稀盐酸,红色消失;
③用F蘸取②中溶液,在酒精灯上灼烧,有白色固体产生.
【思考拓展】
(1)如不使用酸碱指示剂,进一步确认步骤③中的白色固体不是氢氧化钠的方法是:取②中溶液,向其中滴加硫酸铜溶液,无蓝色沉淀
(2)探究步骤②中无色溶液中稀盐酸是否过量.
根据上述反应过程中溶液变成无色,不能确定稀盐酸是否过量,兴趣小组同学又分别选取了AgNO3溶液、紫色石蕊试液、铁粉设计实验方案,请你分析并判断:
方案③中反应的化学方程式Fe+2HCl=FeCl2+H2↑.上述设计方案中,不正确的是①(填“①”、
“②”或“③”),错误的原因是氯化钠溶液中也含Cl-,与硝酸银溶液反应也会生成白色沉淀.
请你再设计一个与上述实验不同原理的方案以确定稀盐酸是否过量,你选用的试剂是加入氧化铜或碳酸钠溶液.
(3)探究Ⅱ:从微观的角度认识物质及其变化的本质.图2表示氢氧化钠溶液与盐酸反应的微观过程,该反应的本质是H+、OH-结合生成水.
探究Ⅰ:证明氢氧化钠溶液与稀盐酸确实能发生反应.
【方案1】测定稀盐酸与NaOH溶液混合前后的pH.
测定某NaOH溶液的pH,pH大于7.将一定量的稀盐酸加入该NaOH溶液中,混合均匀后测定其pH,发现pH减小了,但仍然大于7,小组中有的同学认为根据这个测定结果可以认为稀盐酸与NaOH溶液发生了反应,你认为他们的结论是否正确:不正确,理由滴加的盐酸中含水,加入后使NaOH溶液变稀,同样会使溶液碱性减弱,pH减小.经过讨论后,他们向溶液中又加入一定量的稀盐酸,混合均匀后测定其pH,pH小于7.
结论:稀盐酸与氢氧化钠溶液发生了化学反应,并且稀盐酸过量.
【方案2】借助于无色酚酞试液.
【药品仪器】(如图1)

①取A(选填“A”或“B”)中试剂加入至D中,滴加2滴酚酞试液,溶液呈红色;
②用胶头滴管向①中溶液滴加稀盐酸,红色消失;
③用F蘸取②中溶液,在酒精灯上灼烧,有白色固体产生.
【思考拓展】
(1)如不使用酸碱指示剂,进一步确认步骤③中的白色固体不是氢氧化钠的方法是:取②中溶液,向其中滴加硫酸铜溶液,无蓝色沉淀
(2)探究步骤②中无色溶液中稀盐酸是否过量.
根据上述反应过程中溶液变成无色,不能确定稀盐酸是否过量,兴趣小组同学又分别选取了AgNO3溶液、紫色石蕊试液、铁粉设计实验方案,请你分析并判断:
| 实验方案 | 实验步骤 | 现 象 | 结 论 |
| ① | 取样,加入适量的AgNO3溶液 | 出现白色沉淀 | 稀盐酸过量 |
| ② | 取样,加入几滴紫色石蕊试液 | 溶液变红 | 稀盐酸过量 |
| ③ | 取样,加入少量铁粉 | 黑色固体溶解,产生气泡,溶液变浅绿色 | 稀盐酸过量 |
“②”或“③”),错误的原因是氯化钠溶液中也含Cl-,与硝酸银溶液反应也会生成白色沉淀.
请你再设计一个与上述实验不同原理的方案以确定稀盐酸是否过量,你选用的试剂是加入氧化铜或碳酸钠溶液.
(3)探究Ⅱ:从微观的角度认识物质及其变化的本质.图2表示氢氧化钠溶液与盐酸反应的微观过程,该反应的本质是H+、OH-结合生成水.
1.如图是甲、乙两位同学一起在实验室进行的氢氧化钠与盐酸中和反应的实验.(图中A1、A2、A3、B1、B2、B3均为溶液编号)

根据图中实验,请你与甲、乙同学一起完成下列探究:

根据图中实验,请你与甲、乙同学一起完成下列探究:
| 探究 环节 | 甲同学的探究 | 乙同学的探究 |
| 提出 问题 | A3溶液为什么不变红? | B3溶液中溶质成分是什么?(酚酞不计) |
| 做出 猜想 | 实验过程中,酚酞变质了? | 猜想一:NaCl 猜想二:NaCl HCl |
实验 验证 | (1)取少量A3溶液于另一试管中,向其中滴加NaOH溶液,溶液变红,说明甲同学的猜想不成立(填“成立”或“不成立”) (2)你认为在常温下A2溶液测出的pH <(填“>”、“=”或“<”)7 | 取少量B3溶液加入盛有少量铁粉的试管中,观察到有无色气泡产生,固体逐渐减少,溶液由无色变浅绿色,你认为乙同学的猜想二.(填“一”或“二”)成立 |
交流 反思 | (1)甲、乙同学的实验中,反应均涉及到的化学方程式是NaOH+HCl=NaCl+H2O. (2)A3溶液未变红,你认为原因是A2溶液中盐酸较多,加入的NaOH溶液未将其完全中和. (3)甲、乙同学经过实验对比探究,认为做化学实验时应注意药品用量的控制. | |
18.选择一种试剂鉴别硝酸银、碳酸钠、亚硫酸钠、硝酸钡四种物质( )
0 148184 148192 148198 148202 148208 148210 148214 148220 148222 148228 148234 148238 148240 148244 148250 148252 148258 148262 148264 148268 148270 148274 148276 148278 148279 148280 148282 148283 148284 148286 148288 148292 148294 148298 148300 148304 148310 148312 148318 148322 148324 148328 148334 148340 148342 148348 148352 148354 148360 148364 148370 148378 211419
| A. | H2SO4 | B. | HCl | C. | Cu(OH)2 | D. | Ca(OH)2 |
 如图是甲、乙、丙三种固体物质的溶解度曲线图,请据图回答下列问题.
如图是甲、乙、丙三种固体物质的溶解度曲线图,请据图回答下列问题.