0 129264 129272 129278 129282 129288 129290 129294 129300 129302 129308 129314 129318 129320 129324 129330 129332 129338 129342 129344 129348 129350 129354 129356 129358 129359 129360 129362 129363 129364 129366 129368 129372 129374 129378 129380 129384 129390 129392 129398 129402 129404 129408 129414 129420 129422 129428 129432 129434 129440 129444 129450 129458 211419
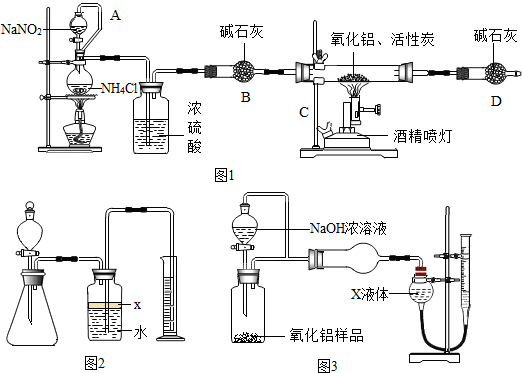
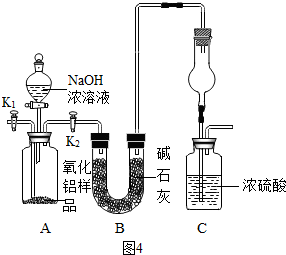
 如图是某化学学习小组设计的用一氧化碳还原氧化铁的实验装置.请回答以下问题:
如图是某化学学习小组设计的用一氧化碳还原氧化铁的实验装置.请回答以下问题: 小明在老师的指导下测一瓶稀盐酸的溶质质量分数,具体步骤如下:
小明在老师的指导下测一瓶稀盐酸的溶质质量分数,具体步骤如下: