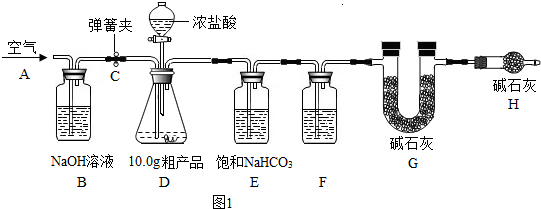
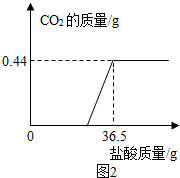
0 128866 128874 128880 128884 128890 128892 128896 128902 128904 128910 128916 128920 128922 128926 128932 128934 128940 128944 128946 128950 128952 128956 128958 128960 128961 128962 128964 128965 128966 128968 128970 128974 128976 128980 128982 128986 128992 128994 129000 129004 129006 129010 129016 129022 129024 129030 129034 129036 129042 129046 129052 129060 211419
 某化学学习小组为比较镁和铝的金属活动性强弱设计了如下实验方案.
某化学学习小组为比较镁和铝的金属活动性强弱设计了如下实验方案. A、B、C、D、E是初中化学常见物质,转化关系如图(图中部分反应物、生成物及反应条件被省略):已知B是一种红色固体,相对分子质量为160,A能使澄清石灰水变浑浊,E是化学实验室常用燃料的主要成分,请回答下列问题:
A、B、C、D、E是初中化学常见物质,转化关系如图(图中部分反应物、生成物及反应条件被省略):已知B是一种红色固体,相对分子质量为160,A能使澄清石灰水变浑浊,E是化学实验室常用燃料的主要成分,请回答下列问题: 已知A、B、C、D、E、F是初中化学常见的六种物质,其中A、B是组成元素相同的两种液态物质,D是改良酸性土壤常用的碱,F是常用的建筑材料的主要成分,它们之间的转化关系如图所示:
已知A、B、C、D、E、F是初中化学常见的六种物质,其中A、B是组成元素相同的两种液态物质,D是改良酸性土壤常用的碱,F是常用的建筑材料的主要成分,它们之间的转化关系如图所示: 为了测定空气中氧气的含量,按如图所示进行实验:
为了测定空气中氧气的含量,按如图所示进行实验: 实验室要测定某氯化铜溶液中溶质的质量分数,取该溶液100g,逐滴滴加一定溶质质量分数的氢氧化钠溶液,反应过程中生成沉淀的质量与加入氢氧化钠溶液质量的关系如图所示.(反应的化学方程式:2NaOH+CuCl2=Cu(OH)2↓+2NaCl)
实验室要测定某氯化铜溶液中溶质的质量分数,取该溶液100g,逐滴滴加一定溶质质量分数的氢氧化钠溶液,反应过程中生成沉淀的质量与加入氢氧化钠溶液质量的关系如图所示.(反应的化学方程式:2NaOH+CuCl2=Cu(OH)2↓+2NaCl) 生活中处处蕴含着化学知识.回答下列问题:
生活中处处蕴含着化学知识.回答下列问题: