0 126698 126706 126712 126716 126722 126724 126728 126734 126736 126742 126748 126752 126754 126758 126764 126766 126772 126776 126778 126782 126784 126788 126790 126792 126793 126794 126796 126797 126798 126800 126802 126806 126808 126812 126814 126818 126824 126826 126832 126836 126838 126842 126848 126854 126856 126862 126866 126868 126874 126878 126884 126892 211419

 如图是模拟炼铁的实验装置.
如图是模拟炼铁的实验装置.
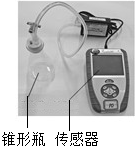 同学们通过查阅资料知道,过氧化氢分解反应的催化剂除二氧化锰外,还有氯化铁溶液和土豆中含有的过氧化氢酶.同学们通过如下实验进行相关研究.
同学们通过查阅资料知道,过氧化氢分解反应的催化剂除二氧化锰外,还有氯化铁溶液和土豆中含有的过氧化氢酶.同学们通过如下实验进行相关研究.
 图为某氮肥包装袋上的标签.小雨通过下述方法检验该氮肥中氮的含量:往装有稀盐酸的小烧杯(总质量为200.Og)加入16.0g该氮肥,充分搅拌,无固体剩余.反应后小烧杯和溶液总质量为207.2g.(已知:NH4HC03+HCl=NH4Cl+H20+C02↑ )
图为某氮肥包装袋上的标签.小雨通过下述方法检验该氮肥中氮的含量:往装有稀盐酸的小烧杯(总质量为200.Og)加入16.0g该氮肥,充分搅拌,无固体剩余.反应后小烧杯和溶液总质量为207.2g.(已知:NH4HC03+HCl=NH4Cl+H20+C02↑ )

 如图,用红磷燃烧来测定空气中氧气的含量,该同学的实验步骤如下:①将图中的集气瓶分为5等份,并作好标记. ②在带橡皮塞和导管的燃烧匙内装入足量的红磷,将导管上的止水夹夹紧在酒精灯上点燃红磷,并立即伸入集气瓶内塞紧橡皮塞. ③充分反应后待集气瓶冷却至室温打开止水夹.请回答下列问题:?
如图,用红磷燃烧来测定空气中氧气的含量,该同学的实验步骤如下:①将图中的集气瓶分为5等份,并作好标记. ②在带橡皮塞和导管的燃烧匙内装入足量的红磷,将导管上的止水夹夹紧在酒精灯上点燃红磷,并立即伸入集气瓶内塞紧橡皮塞. ③充分反应后待集气瓶冷却至室温打开止水夹.请回答下列问题:?