题目内容
1.在一密闭容器内有A、B、C、D四种物质,在一定条件下发生化学反应,一段时间后,测得反应前后各物质的质量如表,则下列说法中正确的是( )| 物 质 | A | B | C | D |
| 反应前物质质量(g) | 10 | 90 | 8 | 2 |
| 反应后物质质量(g) | 38 | 56 | 14 | X |
| A. | 该反应中D一定是催化剂 | B. | 根据质量守恒定律,X的值为0 | ||
| C. | 该反应是分解反应 | D. | 该反应是复分解反应 |
分析 我们知道在化学反应进行的过程中,反应物的质量将不断减少,而生成物则不断增多,因此如果我们发现一种物质的质量随着反应的进行在不断增加,我们就可以判断该物质是此反应的生成物,若某物质随反应的进行在不断减少,则该物质是此反应的反应物,若某物质随反应的进行而质量不变的,则该物质可能是此反应的催化剂或者与该反应无关.根据提供的数据,通过观察和简单计算我们得知:A增加了28g,C增加了6g,而B减少34g,从而判断反应物是B,而生成物是A、C;而且增加的质量之和恰好等于减少的质量,由此可定此反应属于分解反应.由质量守恒定律可知D物质肯定没有参加反应,其质量不发生改变,有可能是该反应的催化剂或者与该反应无关;依据质量守恒定律,该反应是34克B在一定的条件下生成28克A、6克C.
解答 解:A、根据分析可知,D物质可能是此反应的催化剂或者与该反应无关,其质量不变仍为2克;故错误;
B、根据分析可知,D物质肯定没有参加反应,其质量不发生改变,故x=2;故错误;
C、根据分析可知,反应物是B,而生成物是A、C,则属于分解反应;故正确
D、C是正确的,它不属于复分解反应;故错误
故选:C.
点评 本题是考查质量守恒定律判断反应类型及反应物或生成物的质量,此类题在中考中一般以文字叙述或图表的方式进行考查,要求同学们把握住关键词并保持清晰的思路,深刻理解质量守恒定律,并应用定律进行计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列实验操作错误的是( )
| A. |  点燃酒精灯 | B. |  读取液体体积 | C. |  倾倒液体 | D. |  给液体试剂加热 |
12.下列有关实验现象的描述正确的是( )
| A. | 甲烷燃烧生成二氧化碳和水 | B. | 磷在空气中燃烧产生大量白雾 | ||
| C. | 硫在氧气中燃烧产生淡监色火焰 | D. | 镁在空气中燃烧发出耀眼白光 |
9.甲、乙、丙、丁四个化学课外兴趣小组同学分别对各自实验废液中成分进行分析检测,结果如表;检测结果合理的是( )
| 检测小组 | 检测结果 |
| 甲组 | KCl、FeCl3、KOH、HCl |
| 乙组 | NaCl、Ca(NO3)2、K2CO3、HCl |
| 丙组 | NaCl、Mg(NO3)2、K2SO4、H2SO4 |
| 丁组 | KCl、KNO3、K2CO3、KOH |
| A. | 甲组、乙组 | B. | 丙组、丁组 | C. | 甲组、丙组 | D. | 乙组、丁组 |
10.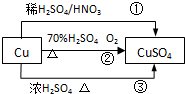 CuSO4是一种重要的化工原料,其有关制备途径如图所示.下列说法不正确的是( )(已知:2Cu+O2+2H2SO4→2CuSO4+2H2O)
CuSO4是一种重要的化工原料,其有关制备途径如图所示.下列说法不正确的是( )(已知:2Cu+O2+2H2SO4→2CuSO4+2H2O)
 CuSO4是一种重要的化工原料,其有关制备途径如图所示.下列说法不正确的是( )(已知:2Cu+O2+2H2SO4→2CuSO4+2H2O)
CuSO4是一种重要的化工原料,其有关制备途径如图所示.下列说法不正确的是( )(已知:2Cu+O2+2H2SO4→2CuSO4+2H2O)| A. | 相对于途径①、③,途径②更好地体现了绿色化学思想 | |
| B. | 途径③中,1mol Cu与足量浓硫酸反应会产生64g SO2气体 | |
| C. | 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2 | |
| D. | 1mol Cu分别按照途径②、③中,被还原的H2SO4的质量之比为1:1 |

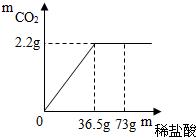 现有7g石灰石样品与稀盐酸反应制取二氧化碳气体,反应产生的二氧化碳气体的质量与加入的稀盐酸的质量关系如图所示.(友情提示:石灰石样品中的杂质不溶于水,也不发生反应,该反应的化学方程式为:
现有7g石灰石样品与稀盐酸反应制取二氧化碳气体,反应产生的二氧化碳气体的质量与加入的稀盐酸的质量关系如图所示.(友情提示:石灰石样品中的杂质不溶于水,也不发生反应,该反应的化学方程式为: