题目内容
16.请根据题意和要求回答下列问题.(1)实验室可用排水法收集氢气的原因是氢气难溶于水.
(2)如图食物中,富含维生素的是BC(填字母序号).

(3)生石灰常用作食品干燥剂,其原理用化学方程式表示为CaO+H2O═Ca(OH)2.
(4)在NH4NO3、K2SO4、KH2PO4、Ca(H2PO4)2四种化肥中,属于复合肥料的是KH2PO4.
分析 (1)根据氢气的性质分析,氢气难溶于水.
(2)营养素包括蛋白质、糖类、油脂、维生素、无机盐和水.
(3)首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可.
(4)含有氮元素的肥料称为氮肥.含有磷元素的肥料称为磷肥.含有钾元素的肥料称为钾肥.同时含有氮、磷、钾三种元素中的两种或两种以上的肥料称为复合肥.
解答 解:(1)氢气难溶于水,所以可以用排水法收集;故答案为:氢气难溶于水;
(2)营养素包括糖类、蛋白质、油脂、维生素、无机盐和水,富含维生素的是水果和蔬菜.故答案为:BC;
(3)生石灰与水反应生成氢氧化钙,反应的化学方程式为:CaO+H2O═Ca(OH)2.故答案为:CaO+H2O═Ca(OH)2.
(4)在NH4NO3、K2SO4、KH2PO4、Ca(H2PO4)2四种化肥中,NH4NO3属于氮肥,K2SO4属于钾肥,Ca(H2PO4)2属于磷肥;KH2PO4中含有钾元素和磷元素,属于复合肥,故答案为:KH2PO4.
点评 注意:化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.

练习册系列答案
相关题目
11.下列同时补充两种植物所需元素的化肥是( )
| A. | NH4Cl | B. | KCl | C. | CaHPO4 | D. | KNO3 |
8.下列措施和理由之间,无因果关系的是( )
| A. | 白磷应保存在冷水中隔绝空气--防止自燃 | |
| B. | 汽油加油站要严禁烟火--防止爆炸 | |
| C. | 家用煤气泄露时要洒大量水溶解--防止火灾 | |
| D. | 长期保存的食品真空包装隔绝空气--防止缓慢氧化 |
6.下列物质的用途主要是化学性质决定的是( )
| A. | 用铜线制作电线 | B. | 沼气燃烧 | ||
| C. | 开水沸腾 | D. | 发烧时病人用酒精降温 |


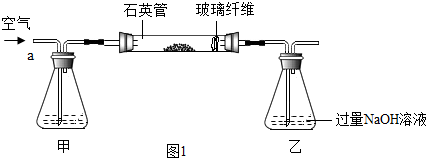
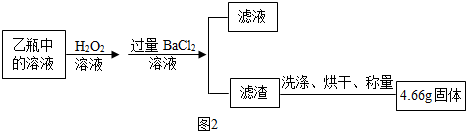
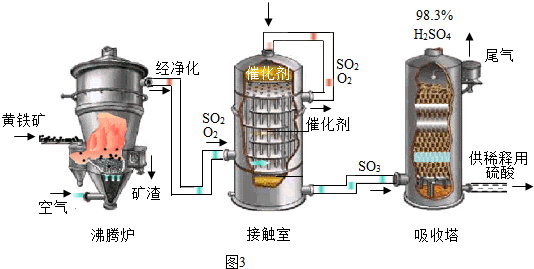
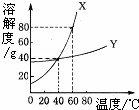 X、Y两种固体物质的溶解度曲线如图所示.回答下列问题:
X、Y两种固体物质的溶解度曲线如图所示.回答下列问题: