题目内容
5.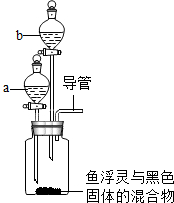 据调查,目前市场有一种产品叫“鱼浮灵”,放在鱼缸中可使水中的含氧量增加,某校科学小组的成员对“鱼浮灵”成分进行探究.
据调查,目前市场有一种产品叫“鱼浮灵”,放在鱼缸中可使水中的含氧量增加,某校科学小组的成员对“鱼浮灵”成分进行探究.【提出问题】“鱼浮灵”的主要成分是什么?
【查阅资料】过碳酸钠,白色结晶颗粒,会与水发生反应,生成碳酸钠和过氧化氢.
【猜想假设】“鱼浮灵”的主要成分是过碳酸钠,若过碳酸钠与水反应的化学方程式是:X+H2O═Na2CO3+H2O2,则过碳酸钠的化学式X为Na2CO4.
【进行实验】(1)在广口瓶中加入少量“鱼浮灵”与黑色固体的混合物,在仪器a中加入水,打开仪器a的活塞,放出适量水后,在导管口放一根带火星的木条,木条复燃,根据此现象可推测处黑色固体在实验中起到了催化作用.
(2)关闭仪器a的活塞,在仪器b中加入稀盐酸液,打开仪器b活塞,放出适量液体后,观察到瓶中产生大量的气泡,生成的气体使澄清的石灰水变浑浊.
【得出结论】“鱼浮灵”的主要成分是过碳酸钠.
【知识拓展】(1)鱼缸的水中加入“鱼浮灵”,液体的PH值为大于7.
(2)请写出过碳酸钠与盐酸反应的化学方程式2Na2CO4+4HCl═4NaCl+2CO2↑+2H2O+O2↑.
分析 【猜想假设】根据化学反应前后,原子种类和数目不变来分析解答;
【进行实验】(1)由题目的信息可知:在广口瓶中加入少量“鱼浮灵”与黑色固体的混合物,产生大量气泡,将带火星木条伸入试管,木条复燃,说明有O2生成;
(2)根据碳酸钠和盐酸反应生成氯化钠和水和二氧化碳,因此二氧化碳能使澄清的石灰水变浑浊分析.
【知识拓展】(1)根据过碳酸钠与水反应生成碳酸钠和过氧化氢,碳酸钠溶液显碱性解答;
(2)根据过碳酸钠与盐酸反应原理写出反应的化学方程式.
解答 解:【猜想假设】由质量守恒定律知,反应前:Na、C、H、O的原子个数分别是0、0、2、1;反应后:Na、C、H、O的原子个数分别是2、2、2、5;
化学式X中含有两个钠原子、一个碳原子和四个氧原子,所以X化学式是Na2CO4.
【进行实验】(1)由题目的信息可知:在广口瓶中加入少量“鱼浮灵”与黑色固体的混合物,在仪器a中加入水,打开仪器a的活塞,放出适量水后,在导管口放一根带火星的木条,木条复燃,说明有O2生成;因此该反应是鱼浮灵在黑色固体的作用下分解产生氧气,根据此现象可推测处黑色固体在实验中起到了催化作用;
(2)碳酸钠和盐酸反应生成氯化钠和水和二氧化碳,因此二氧化碳能使澄清的石灰水变浑浊;
【知识拓展】(1)过碳酸钠与水反应生成碳酸钠和过氧化氢,碳酸钠溶液显碱性,液体的PH值为大于7;
(2)过碳酸钠与盐酸反应的化学方程式为:2Na2CO4+4HCl═4NaCl+2CO2↑+2H2O+O2↑
答案:
【猜想假设】Na2CO4.
【进行实验】(1)催化;(2)稀盐酸;
【知识拓展】(1)大于7;(2)2Na2CO4+4HCl═4NaCl+2CO2↑+2H2O+O2↑.
点评 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案| A. | X>Z>Y | B. | X>Y>Z | C. | Y>X>Z | D. | Z>X>Y |

| A. | →CuCl2→NH4Cl→出口 | B. | →Fe→盐酸→出口 | ||
| C. | →Fe→NaCl→C→KNO3→出口 | D. | →CO2→Cu→出口 |
 a、b、c三种物质的溶解度曲线如图所示.
a、b、c三种物质的溶解度曲线如图所示.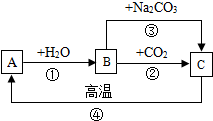 A、B、C是三种常见的含钙化合物.它们之间有如图所示的转化关系(部分产物略去).
A、B、C是三种常见的含钙化合物.它们之间有如图所示的转化关系(部分产物略去).


 回答下列有关Zn、Fe、Cu、Ag的相关问题:
回答下列有关Zn、Fe、Cu、Ag的相关问题: