题目内容
12. 按如图连接好装置图,打开止水夹a在乙中产生的现象是导管下端产生气泡;,反应片刻后夹紧止水夹a,此时乙中出现的现象是出现白色沉淀,写出乙中反应的化学方程式AlCl3+3AgNO3=Al(NO3)3+3 AgCl↓ 或 HCl+AgNO3=HNO3+AgCl↓.
按如图连接好装置图,打开止水夹a在乙中产生的现象是导管下端产生气泡;,反应片刻后夹紧止水夹a,此时乙中出现的现象是出现白色沉淀,写出乙中反应的化学方程式AlCl3+3AgNO3=Al(NO3)3+3 AgCl↓ 或 HCl+AgNO3=HNO3+AgCl↓.
分析 根据稀盐酸与铝反应能生成氢气和氯化铝和装置内气压变化情况分析相关现象;书写化学方程式是要注意配平与气体生成号或沉淀号
解答 解:根据稀盐酸与铝反应能生成氢气和氯化铝可知:打开止水夹a,则可以观察到的现象是:乙试管中导管下端产生气泡;夹紧止水夹a后甲试管中的气体把试管中的液体压入乙试管,使得氯化铝溶液或盐酸与硝酸银溶液反应产生氯化银沉淀;书写化学方程式是要注意配平与气体生成号或沉淀号.
故答案为:
导管下端产生气泡;出现白色沉淀;
AlCl3+3AgNO3=Al(NO3)3+3 AgCl↓ 或 HCl+AgNO3=HNO3+AgCl↓.
点评 本题考查利用课本知识解决新问题能力,能加深学生对课本知识的理解,训练学生的思维能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.研究小组进行木炭还原氧化铁的探究活动.将木炭、氧化铁及试管充分烘干,并将木炭和氧化铁混合均匀、研磨.取适量上述混合物于试管中,用图1所示的装置加热(试管竖直向上,可使加热时的热量尽少散失).
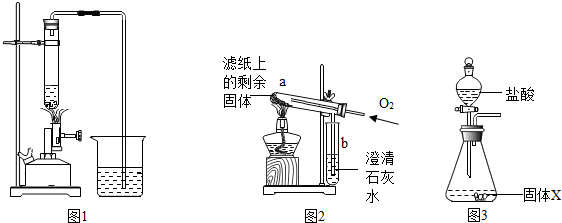
【提出问题】实验结束后,试管中的剩余固体X含有哪些成分,质量分别是多少?
【查阅资料】
铁的氧化物被还原时,是从高价铁的氧化物逐级还原成低价铁的氧化物,最后还原成金属铁.铁的氧化物及其部分性质如下:
Fe2O3为红色固体; Fe3O4和FeO均为黑色固体.其中,Fe3O4具有很好的磁性,能被磁铁吸引.三种氧化物均不溶于水,但能溶于稀盐酸,分别发生如下反应:
Fe2O3+6HCl═2FeCl3+3H₂O
Fe3O4+8HCl═2FeCl3+FeCl2+4H2O
FeO+2HCl═FeCl2+H2O
黄色的FeCl3溶液中滴入无色的KSCN溶液,溶液变为红色,该实验常用于检验FeCl3;FeCl3溶液遇单质铁发生反应:2FeCl3+Fe=3FeCl2,溶液变为浅绿色.
【猜想】固体X可能含有:①Fe ②FeO ③Fe3O4 ④Fe2O3 ⑤C
【实施实验】
目的:确定固体X的组成.
【反思改进】
同学们讨论发现,用上述实验方法不能确定固体X中一定没有Fe3O4,理由是固体X中如果含有Fe3O4,步骤V中加盐酸后,由于铁与FeCl3反应生成FeCl2,遇KSCN溶液也不变血红色.
为确定固体X中是否含Fe3O4并测定其中各成分的质量,同学们又进行了以下实验:
【获得结论】
(1)为确定固体X中是否含Fe3O4,m1~m4中应该用到的数据有m1、m2、m3和m4.
(2)固体X的成分及质量分别是C是1.1g,Fe是16.8g.

【提出问题】实验结束后,试管中的剩余固体X含有哪些成分,质量分别是多少?
【查阅资料】
铁的氧化物被还原时,是从高价铁的氧化物逐级还原成低价铁的氧化物,最后还原成金属铁.铁的氧化物及其部分性质如下:
Fe2O3为红色固体; Fe3O4和FeO均为黑色固体.其中,Fe3O4具有很好的磁性,能被磁铁吸引.三种氧化物均不溶于水,但能溶于稀盐酸,分别发生如下反应:
Fe2O3+6HCl═2FeCl3+3H₂O
Fe3O4+8HCl═2FeCl3+FeCl2+4H2O
FeO+2HCl═FeCl2+H2O
黄色的FeCl3溶液中滴入无色的KSCN溶液,溶液变为红色,该实验常用于检验FeCl3;FeCl3溶液遇单质铁发生反应:2FeCl3+Fe=3FeCl2,溶液变为浅绿色.
【猜想】固体X可能含有:①Fe ②FeO ③Fe3O4 ④Fe2O3 ⑤C
【实施实验】
目的:确定固体X的组成.
| 步骤 | 操作 | 主要现象 | 结论 |
| Ⅰ | 取部分冷却后的固体X倒在滤纸上,用磁铁充分吸引. | 部分固体被吸引到磁铁上 | 可能有Fe或Fe3O4 |
| Ⅱ | 取滤纸上的剩余固体少量,放入图2所示的试管a中,通入氧气,用酒精灯加热. | 固体剧烈燃烧,b中溶液变浑浊 | 一定有C |
| Ⅲ | 另取滤纸上的剩余固体少量,放入试管中,加入足量的稀盐酸. | 无明显现象 | 一定没有FeO和Fe2O3 |
| Ⅳ | 取步骤I磁铁上的固体少量,放入试管中,逐滴加入稀盐酸. | 产生气泡. | 一定有Fe |
| Ⅴ | 在步骤IV所得溶液中逐滴加入KSCN溶液. | 溶液不变红色 | 一定没有Fe3O4 |
同学们讨论发现,用上述实验方法不能确定固体X中一定没有Fe3O4,理由是固体X中如果含有Fe3O4,步骤V中加盐酸后,由于铁与FeCl3反应生成FeCl2,遇KSCN溶液也不变血红色.
为确定固体X中是否含Fe3O4并测定其中各成分的质量,同学们又进行了以下实验:
| 步骤 | 操作 | 数据 |
| Ⅰ | 重新取部分冷却至室温的固体X,称量其质量为m1. | m1=17.9g |
| Ⅱ | 将称量好的固体X全部放入图3所示的锥形瓶中,称量整套装置及药品的质量为m2;打开分液漏斗旋塞,放入足量稀盐酸后关闭旋塞,待没有气泡产生并恢复至室温,再次称量整套装置及药品的质量为m3. | m2=317.9g m3=317.3.g |
| Ⅲ | 将锥形瓶中剩余的固体过滤、洗涤并干燥,称量其质量为m4. | m4=1.1g |
(1)为确定固体X中是否含Fe3O4,m1~m4中应该用到的数据有m1、m2、m3和m4.
(2)固体X的成分及质量分别是C是1.1g,Fe是16.8g.
3.下列对汽车尾气的分析,推测最合理的是( )
| A. | 发动汽车时,排气管有白雾,说明其中可能含有氧气 | |
| B. | 尾气有刺激性气味,说明其中含有稀有气体 | |
| C. | 发动汽车时,排气管有白雾,说明其中可能含有五氧化二磷 | |
| D. | 汽车尾气有刺激性气味,说明其中可能含有二氧化硫 |
20.高铁酸钠(Na2FeO4)是一种新型高效的水处理剂,下列有关高铁酸钠(Na2FeO4)的说法正确的是( )
| A. | 属于氧化物 | |
| B. | 钠、铁、氧三种元素的质量比为2:1:4 | |
| C. | 铁元素的化合价为+6 | |
| D. | 高铁酸钠是由2个钠元素、1个铁元素、4个氧元素组成的物质 |
17.有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y表面有银析出,而Z没有变化.根据以上实验事实,判断这三种金属的活动性由强到弱的顺序为( )
| A. | Z Y X | B. | Y X Z | C. | X Y Z | D. | X Z Y |
1.在自来水消毒过程通常要发生化学反应,其反应的微观过程可用如图所示:

则下列判断正确的是( )

则下列判断正确的是( )
| A. | 反应物中无单质 | B. | 这是一个分解反应 | ||
| C. | 这是一个化合反应 | D. | 反应前后原子个数类不变 |
2.将镁粉加入到一定量的硫酸亚铁和硫酸铜的混合溶液中,待充分反应后过滤,向滤出的固体中加入稀盐酸,有气泡产生.下列关于滤液和固体物质中成分的判断错误的是( )
| A. | 滤液中一定含有硫酸亚铁 | |
| B. | 滤液中一定不含硫酸铜 | |
| C. | 滤出的固体中一定含有铜和铁,可能含镁 | |
| D. | 滤液中一定含有硫酸镁 |
