题目内容
1.筑材料有砖、钢筋、水泥、生石灰、大理石、PVC塑料(聚氯乙烯)等,对上述一些建筑材料主要成分的分类不正确的是( )| A. | 铁--单质 | B. | 生石灰--氧化物 | C. | 碳酸钙--酸 | D. | PVC塑料--有机物 |
分析 可以根据具体的物质进行分析、判断,从而得出正确的结论.
解答 解:A、铁是由同种元素组成的纯净物,属于单质.
B、生石灰是由两种元素组成,其中一种元素是氧元素,属于氧化物.
C、碳酸钙是由金属离子和酸根离子组成的化合物,属于盐.
D、PVC塑料是含有碳元素的化合物,属于有机物.
故选C.
点评 本题主要考查了物质的分类方法方面的内容,难度不大.

练习册系列答案
相关题目
12.“低碳生活”倡导我们在生活中所耗用的能量,材料要尽量减少,从而减低二氧化碳的排放量.下列做法不符合“低碳生活”理念的是( )
| A. | 学生的课本循环使用 | |
| B. | 与同学联系时多用电子邮箱、QQ等即时通讯工具,少用纸质书信或明信片 | |
| C. | 冬天为了取暖,把室内空调温度设置到很高 | |
| D. | 提倡乘坐公共交通工具、骑自行车或步行等出行方式 |
16.下列关于能量转化的说法中不正确的是( )
| A. | 洗衣机工作时,电能主要转化为机械能 | |
| B. | 汽车匀速下坡时,重力势能转化为动能 | |
| C. | 绿色植物的光合作用将光能转化为化学能 | |
| D. | 给电动车的电池充电,是将电能转化为化学能 |
13.下列实验现象描述正确的是( )
| A. | 铁丝在氧气中燃烧:银白色固体剧烈燃烧,火星四射,放出大量的热,生成黑色固体 | |
| B. | 高温条件下木炭还原氧化铜:黑色固体逐渐变成光亮的铜 | |
| C. | 电解水实验:两个电极附近产生气泡,一段时间后,正、负极产生的气体体积比约为2:1 | |
| D. | 铜片放人硝酸银溶液中:紫红色固体表面有银白色固体产生,溶液由蓝色逐渐变为无色 |
10.理科实验操作考试中,小明同学在做铝和稀盐酸反应时无意中加入几滴硫酸铜溶液,发现铝片表面产生气泡速率明显增快,对此他产生了兴趣.
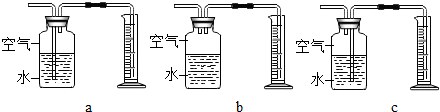
【提出问题】硫酸铜溶液是不是此反应的催化剂?硫酸铜溶液的体积对此实验有影响吗?
【设计并实验】室温下,小明将过量、表面积相同已打磨的铝片分别加入到6份30mL10%稀盐酸中,并在每份中加入不同体积的硫酸铜饱和溶液,记录获得相同体积氢气的时间,从而确定产生氢气的速率.
(1)如表表格中V=15;
(2)写出铝和稀盐酸反应的化学方程式2Al+6HCl═2AlCl3+3H2↑:
(3)定量收集氢气体积可用如图c(填写字母序号)装置.
【实验现象】随着硫酸铜溶液体积的增加,产生氢气的速率先加快后明显减慢,且铝片表面附着的红色物质逐渐增加.
【结论与解释】
(4)随着硫酸铜体积的增加,反应速率明显变慢可能的原因是部分铝和硫酸铜溶液发生了置换反应;
(5)根据实验现象小明认为硫酸铜溶液不是此反应的催化剂,其原因是硫酸铜质量发生了改变且和铝发生了反应;
【实验反思】加速铝和稀硫酸反应速率还可以采取的措施是(写出一点)提高温度,增大盐酸浓度等.
【实验拓展】根据上述实验,小明认为是盐中的金属离子影响了铝和稀盐酸的反应速率;为了研究不同金属离子对反应的影响,小明同学继续实验,取过量表面积相同的铝片和30mL10%稀盐酸混合后加入不同的盐溶液,实验现象如表(加号越多,代表反应速率越快):
(6)如表中,用水进行实验的目的进行对照;;
(7)上述实验设计存有缺陷,该缺陷是铝片未经过表面打磨;实验改进后,任符合上表中的实验现象,可得到的实验结论是:
①Na+、Mg2+ 对实验效果没有明显效果;②Fe2+、Cu2+能加快铝和稀盐酸反应的速率,且Cu2+ 效果最好.

【提出问题】硫酸铜溶液是不是此反应的催化剂?硫酸铜溶液的体积对此实验有影响吗?
【设计并实验】室温下,小明将过量、表面积相同已打磨的铝片分别加入到6份30mL10%稀盐酸中,并在每份中加入不同体积的硫酸铜饱和溶液,记录获得相同体积氢气的时间,从而确定产生氢气的速率.
| 实验混合溶液 | 1 | 2 | 3 | 4 | 5 | 6 |
| 饱和硫酸铜溶液/mL | 0 | 0.5 | 2.5 | 5 | 10 | 20 |
| 水/mL | 20 | 19.5 | 17.5 | V | 10 | 0 |
(2)写出铝和稀盐酸反应的化学方程式2Al+6HCl═2AlCl3+3H2↑:
(3)定量收集氢气体积可用如图c(填写字母序号)装置.
【实验现象】随着硫酸铜溶液体积的增加,产生氢气的速率先加快后明显减慢,且铝片表面附着的红色物质逐渐增加.
【结论与解释】
(4)随着硫酸铜体积的增加,反应速率明显变慢可能的原因是部分铝和硫酸铜溶液发生了置换反应;
(5)根据实验现象小明认为硫酸铜溶液不是此反应的催化剂,其原因是硫酸铜质量发生了改变且和铝发生了反应;
【实验反思】加速铝和稀硫酸反应速率还可以采取的措施是(写出一点)提高温度,增大盐酸浓度等.
【实验拓展】根据上述实验,小明认为是盐中的金属离子影响了铝和稀盐酸的反应速率;为了研究不同金属离子对反应的影响,小明同学继续实验,取过量表面积相同的铝片和30mL10%稀盐酸混合后加入不同的盐溶液,实验现象如表(加号越多,代表反应速率越快):
| 实验1 | 实验2 | 实验3 | 实验4 | 实验5 | |
| 加入试剂0.5mL | 水 | 5%NaCl溶液 | 5%Mg(NO3)2溶液 | 5%FeSO4溶液 | 5%CuSO4溶液 |
| 产生气泡速率 | + | + | + | ++ | +++ |
(7)上述实验设计存有缺陷,该缺陷是铝片未经过表面打磨;实验改进后,任符合上表中的实验现象,可得到的实验结论是:
①Na+、Mg2+ 对实验效果没有明显效果;②Fe2+、Cu2+能加快铝和稀盐酸反应的速率,且Cu2+ 效果最好.
