题目内容
20.为探究氢氧化钙溶液和稀盐酸反应所得溶液中溶质的成分,同学们通过测定了反应后溶液的pH,得到了如图所示的pH曲线,请回答: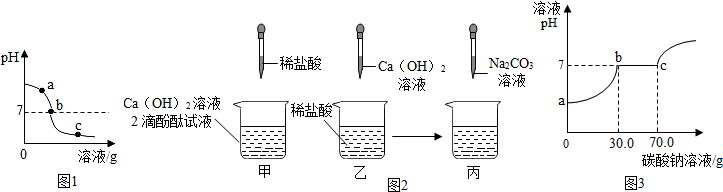
(1)由图1可知该实验操作是将稀盐酸滴加到另一种溶液中;
(2)该反应的化学方程式为Ca(OH)2+2HCl═CaCl2+2H2O;
(3)实验过程中,取a、b、c三处反应后的溶液于三个烧杯中,但是忘了做标记,同学们通过设计方案(不再用测定pH的方法),探究三种样品分别属于哪处溶液.
【查阅资料】CaCl2溶液显中性,CaCl2+Na2CO3═CaCO3↓+2NaCl.
【探究过程】
①分别取少量样品于三支试管中,加入酚酞试液,观察到其中一支试管内出现溶液由无色变成红色的现象.结论:该样品是a处溶液.
②为进一步确定b或c处溶液,又设计了如表方案:
| 实验步骤 | 实验现象 | 实验结论 |
| 另取余下样品少量于两支试管中,分别滴加足量的Na2CO3溶液. | ①只产生白色沉淀 | 该样品为b处溶液. |
| ②先产生气泡,后产生白色沉淀 | 该样品为c处溶液,并推知溶液中的阳离子有Ca2+、H+ |
①甲实验恰好中和,则该溶液中的溶质是CaCl2(化学式).
②取乙反应后的溶液60.0g,滴加质量分数26.5%的Na2CO3溶液,如图2丙,溶液pH的变化如图3,请计算该溶液中CaCl2的溶质质量分数18.5%(写出计算过程,精确到0.1%).
分析 (1)根据溶液的pH变化情况来分析;
(2)考虑酸碱中和生成盐和水,根据反应原理来书写;
(3)根据溶液的酸碱性以及碳酸钠的化学性质来分析.物质之间发生化学反应时,可能恰好完全反应,也可能有的反应物有剩余;合理设计实验,通过实验现象可以判断物质的组成情况.
(4)①根据盐酸和氢氧化钙的反应进行分析;
②反应后的溶液是氯化钙溶液,和碳酸钠溶液反应生成碳酸钙沉淀,根据化学反应方程式进行分析计算;
解答 解:(1)由图象可知,该溶液的pH由大到小,说明是向碱溶液中滴加酸,故填:稀盐酸;
(2)因为氢氧化钙与稀盐酸反应生成氯化钙和水;故其化学方程式为:Ca(OH)2+2HCl═CaCl2+2H2O;
(3)【探究过程】
①根据图可知:a处的溶液显碱性,加入酚酞试液,观察到其中一支试管内出现溶液由无色变成红色的现象;故填:溶液由无色变成红色;
②根据图可知:b处溶液为氢氧化钙与稀盐酸恰好反应,生成氯化钙中性溶液;而c处的溶液显酸性,溶液中的溶质是氯化钙和氯化氢,其中的阳离子是钙离子和氢离子,溶液显酸性,加入碳酸钠后,先与稀盐酸反应生成二氧化碳气体,当盐酸完全反应后再与氯化钙反应生成白色沉淀;
故答案为:
| 实验步骤 | 实验现象 | 结论 |
| 只产生白色沉淀 | ||
| 先产生气泡,后产生白色沉淀 | Ca2+、H+ |
②由图可知,碳酸钠溶液的量到70g时,反应正好完成;氯化钙和碳酸钠的反应生成碳酸钙和水,据题意,设参加反应的CaCl2的质量为x,则
CaCl2+Na2CO3=CaCO3↓+2NaCl
111 106
x 40g×26.5%
则$\frac{111}{x}=\frac{106}{40g×26.5%}$,解得:x=11.1g
该CaCl2溶液的溶质质量分数为:$\frac{11.1g}{60g}$×100%≈18.5%
故答案为:
(1)稀盐酸;(2)Ca(OH)2+2HCl═CaCl2+2H2O;
(3)①溶液由无色变成红色.②
| 实验步骤 | 实验现象 | 实验结论 |
| 只产生白色沉淀 | ||
| 先产生气泡,后产生白色沉淀 | Ca2+、H+. |
点评 本题考查了碱的化学性质,学生应熟悉碱的通性,并能利用信息结合碱的性质来解决问题,(1)中反应与图象相结合,明确图象中曲线的变化是解答的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.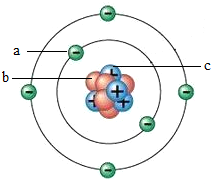 图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子,下列说法正确的是( )
图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子,下列说法正确的是( )
 图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子,下列说法正确的是( )
图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子,下列说法正确的是( )| A. | 决定该原子种类的粒子是b | B. | 原子中b与c的数目一定相同 | ||
| C. | 原子中a与c的数目一定相同 | D. | 原子的质量集中在a和c上 |
11.南海、钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源.
(1)海水制盐.从海水制取的粗盐中含有泥沙、硫酸镁和氯化钙等杂质.为得到较纯的氯化钠,将粗盐溶于水,然后进行如下操作:a.加过量的Ba(OH)2溶液;b.加稍过量的盐酸;c.加过量的Na2CO3溶液;d.过滤;e.蒸发.正确的操作顺序是acdbe(填字母).加Na2CO3溶液的作用是除去氯化钙和过量试剂氢氧化钡.
(2)海水淡化.图1是一个简易的蒸馏法淡化海水的装置.证明得到的水是淡水的最简便方法是蒸干后没有晶体析出.
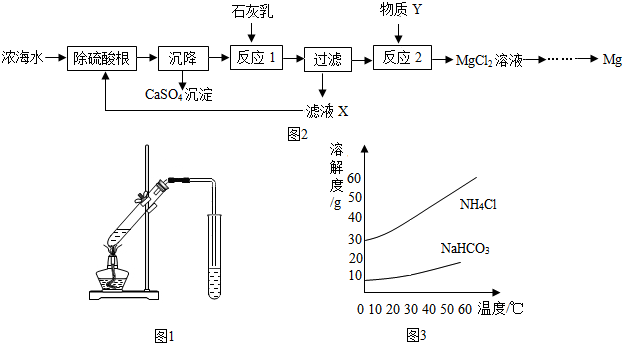
(3)海水制镁.浓海水中主要离子的浓度如上表.从浓海水中提取金属镁的一段工艺流程如图2所示:
写出反应1的化学方程式:Ca(OH)2+MgCl2=CaCl2+Mg(OH)2↓.滤液X中溶质的主要成分有CaCl2、NaCl(填化学式).将MgCl2溶液在一定条件下蒸发结晶、熔融电解可制得金属镁.则2L浓海水理论上可得到金属镁的质量为57.6g.
(4)海水“制碱”.氨碱法制纯碱是先向饱和食盐水通入氨气、二氧化碳生成NaHCO3和NH4Cl,NaHCO3结晶析出,再加热NaHCO3制得纯碱.写出生成NaHCO3和NH4Cl的化学方程式为NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl;反应中生成NaHCO3和NH4Cl的质量比为84:53.5,NaHCO3和NH4Cl的溶解度曲线如图3所示.请分析NaHCO3结晶析出而NH4Cl没有结晶析出的原因是生成的NaHCO3质量比NH4Cl多而溶解度比NH4Cl小,先达到饱和.
(1)海水制盐.从海水制取的粗盐中含有泥沙、硫酸镁和氯化钙等杂质.为得到较纯的氯化钠,将粗盐溶于水,然后进行如下操作:a.加过量的Ba(OH)2溶液;b.加稍过量的盐酸;c.加过量的Na2CO3溶液;d.过滤;e.蒸发.正确的操作顺序是acdbe(填字母).加Na2CO3溶液的作用是除去氯化钙和过量试剂氢氧化钡.
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/g/L | 63.7 | 28.8 | 144.6 | 46.4 |

(3)海水制镁.浓海水中主要离子的浓度如上表.从浓海水中提取金属镁的一段工艺流程如图2所示:
写出反应1的化学方程式:Ca(OH)2+MgCl2=CaCl2+Mg(OH)2↓.滤液X中溶质的主要成分有CaCl2、NaCl(填化学式).将MgCl2溶液在一定条件下蒸发结晶、熔融电解可制得金属镁.则2L浓海水理论上可得到金属镁的质量为57.6g.
(4)海水“制碱”.氨碱法制纯碱是先向饱和食盐水通入氨气、二氧化碳生成NaHCO3和NH4Cl,NaHCO3结晶析出,再加热NaHCO3制得纯碱.写出生成NaHCO3和NH4Cl的化学方程式为NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl;反应中生成NaHCO3和NH4Cl的质量比为84:53.5,NaHCO3和NH4Cl的溶解度曲线如图3所示.请分析NaHCO3结晶析出而NH4Cl没有结晶析出的原因是生成的NaHCO3质量比NH4Cl多而溶解度比NH4Cl小,先达到饱和.
5.下列实验操作错误的是( )
| A. |  蒸发食盐水 | B. |  滴管的使用 | ||
| C. |  检查装置的气密性 | D. |  稀释浓硫酸 |
12.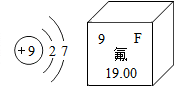 某元素原子结构示意图及在元素周期表中的相关信息如图所示,下列说法正确的是( )
某元素原子结构示意图及在元素周期表中的相关信息如图所示,下列说法正确的是( )
 某元素原子结构示意图及在元素周期表中的相关信息如图所示,下列说法正确的是( )
某元素原子结构示意图及在元素周期表中的相关信息如图所示,下列说法正确的是( )| A. | 该元素的名称为F | |
| B. | 该元素的原子序数为9 | |
| C. | 该元素的相对原子质量为19 | |
| D. | 该元素原子在化学反应中容易失去电子变为阳离子 |
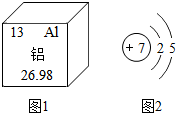 铝元素与人类关系密切.
铝元素与人类关系密切.