题目内容
15.用足量的一氧化碳还原某三价金属R的氧化物m克,得到n克金属,已知氧的相对原子质量为16,则R的原子量是$\frac{24n}{m-n}$.分析 由化学方程式可以根据物质的实际质量来计算相对原子质量.
解答 解:设R的相对原子质量为x.
3CO+R2O3$\frac{\underline{\;高温\;}}{\;}$2R+3CO2
2x+16×3 x×2
mg ng
$\frac{2x+16×3}{mg}=\frac{2x}{ng}$
解得 x=$\frac{24n}{m-n}$
故填:$\frac{24n}{m-n}$.
点评 本题主要考查有关化学方程式的常规计算,难度较小,属基础性知识考查题.

练习册系列答案
相关题目
12.如图实验基本操作错误的是( )
| A. |  加热液体 | B. |  稀释浓硫酸 | ||
| C. |  测定溶液pH | D. |  向试管内倾倒液体 |
3.某化学课外兴趣小组探究氢气还原氧化铜的反应,有如下实验装置:
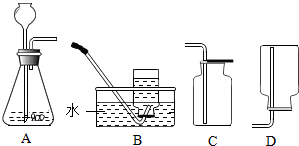
(1)上述A装置可用于实验室制取氢气和二氧化碳,请分别写出实验室制取氢气和二氧化碳的化学方程式Zn+H2SO4=ZnSO4+H2↑;CaCO3+2HCl=CaCl2+H2O+CO2↑;
上述可用于收集二氧化碳装置是C(用装置字母序号填空).
(2)请你参与探究氢气还原氧化铜得到的红色固体的成分,完成下列各题:
已知信息:Ⅰ.氢气还原氧化铜除生成铜外还可能生成氧化亚铜(Cu2O);Ⅱ.Cu和Cu2O均为不溶于水的红色固体;Ⅲ.Cu2O+H2SO4=CuSO4+Cu+H2O
提出问题:红色固体含有什么物质?
①猜想假设:
假设一:红色固体只含Cu;假设二:红色固体只含Cu2O;
假设三:红色固体含有Cu和Cu2O(请补充完成假设三).
②实验探究:(填写表中空格)
③数据处理:甲同学称取Wg红色固体加入到足量硫酸溶液中使其充分反应后,(填操作名称)、洗涤、干燥,称量剩余红色固体质量为mg,通过计算,若m=$\frac{64w}{144}$g(选填>、<或=),则假设二成立;若m<$\frac{64w}{144}$g(选填>、<或=),则假设三成立.
④交流与反思:只要假设合理,实验方法正确,根据实验现象和数据就能得出结论.

(1)上述A装置可用于实验室制取氢气和二氧化碳,请分别写出实验室制取氢气和二氧化碳的化学方程式Zn+H2SO4=ZnSO4+H2↑;CaCO3+2HCl=CaCl2+H2O+CO2↑;
上述可用于收集二氧化碳装置是C(用装置字母序号填空).
(2)请你参与探究氢气还原氧化铜得到的红色固体的成分,完成下列各题:
已知信息:Ⅰ.氢气还原氧化铜除生成铜外还可能生成氧化亚铜(Cu2O);Ⅱ.Cu和Cu2O均为不溶于水的红色固体;Ⅲ.Cu2O+H2SO4=CuSO4+Cu+H2O
提出问题:红色固体含有什么物质?
①猜想假设:
假设一:红色固体只含Cu;假设二:红色固体只含Cu2O;
假设三:红色固体含有Cu和Cu2O(请补充完成假设三).
②实验探究:(填写表中空格)
| 实验操作 | 实验现象 | 实验结论 |
| a.取少量红色固体加入到足量硫酸溶液中 | 无明显现象 | 假设成立假设一 |
| b.取少量红色固体加入到足量硫酸溶液中 | 有红色固体剩余 | 假设二和假设三均成立 |
④交流与反思:只要假设合理,实验方法正确,根据实验现象和数据就能得出结论.
10.A、B、C、D四种物质各10克,放入密闭容器中,一定条件下充分反应后,称量,A为12克,B的质量未知,C为6克,D的质量大于10克,则关于A、B、C、D的说法正确的是( )
| A. | A、B是反应物,C、D是生成物 | |
| B. | B可能是催化剂,A、D一定是生成物 | |
| C. | 反应过程中,当容器中C的质量为8克时,D的质量为6克 | |
| D. | 反应结束后经检验B不存在,则容器中D的质量为22克 |
20.呼吸作用及光合作用都离不开空气.下列关于空气的说法正确的是( )
| A. | 空气是一种化合物 | |
| B. | 空气是几种单质和几种化合物组成的混合物 | |
| C. | 新鲜的空气是纯净物 | |
| D. | 空气是几种元素的混合物 |
4.两包粉末,一是铁粉,二是氧化铜粉,快速将它们鉴别出来的方法是( )
| A. | 观察颜色,加以鉴别? | |
| B. | 分别加水溶解,加以鉴别? | |
| C. | 用磁铁吸引,加以鉴别 | |
| D. | 装入试管中分别加热,再分别通入H2观察现象,加以鉴别? |
5.下表是小华对自己吸人的气体和呼出的气体进行探究的结果:
①请你判断x是氮气,y是氧气.
②请你回答:
因参与新陈代谢而被人体消耗的是氧气.
③请你证明:
呼出气体中含有较多水蒸气,你们实验方法是:对着干燥而冷却的玻璃片呼气,玻璃片上出现较多的水雾,说明呼出气体中含有较多的水蒸气.
| 气体 | x | Y | 二氧化碳 | 水蒸气 |
| 吸入气体 | 78.26% | 21.04% | 0.03% | 0.67% |
| 呼出气体 | 74.88% | 15.26% | 3.68% | 6.18% |
②请你回答:
因参与新陈代谢而被人体消耗的是氧气.
③请你证明:
呼出气体中含有较多水蒸气,你们实验方法是:对着干燥而冷却的玻璃片呼气,玻璃片上出现较多的水雾,说明呼出气体中含有较多的水蒸气.
 用如图所示装置进行″探究空气中氧气含量″的实验.实验步骤如下:①先用止水夹夹紧橡皮管;②点燃燃烧匙里的红磷;③迅速将燃烧匙插入集气瓶,并塞紧塞子;④燃烧完毕并冷却后,打开止水夹.
用如图所示装置进行″探究空气中氧气含量″的实验.实验步骤如下:①先用止水夹夹紧橡皮管;②点燃燃烧匙里的红磷;③迅速将燃烧匙插入集气瓶,并塞紧塞子;④燃烧完毕并冷却后,打开止水夹. 某实验小组同学设计了如图装置模拟氢气探空气球(装置中气球固定在矿泉水瓶上).将气球中的镁条加入到硫酸溶液中,恰好完全反应.
某实验小组同学设计了如图装置模拟氢气探空气球(装置中气球固定在矿泉水瓶上).将气球中的镁条加入到硫酸溶液中,恰好完全反应.