题目内容
11.A~G是初中常见的7种物质,它们有如图所示的转化关系(部分产物已略去).已知A、C是无色液体,B、F是无色气体,其中F有刺激性气味,D是黄色液体,G是紫黑色固体.
(1)请写出下列物质的名称:G高锰酸钾,A过氧化氢溶液;
(2)请写出下列反应的化学方程式:
①C→B+H2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑.
②B+D→FS+O2$\frac{\underline{\;点燃\;}}{\;}$SO2.
(3)上述过程中所发生的化学变化属于化合反应的有1个.
分析 根据题意,已知A、C是无色液体,A能在二氧化锰的作用下产生B和C,C能够电解产生B和H,因此A是过氧化氢溶液,B是氧气,C是水,则H是氢气;F是无色气体,其中F有刺激性气味,D是黄色液体,因此D是硫,F是二氧化硫,G是紫黑色固体能够产生氧气,因此G是高锰酸钾,据此进行分析解答.
解答 解:A、C是无色液体,A能在二氧化锰的作用下产生B和C,C能够电解产生B和H,因此A是过氧化氢溶液,B是氧气,C是水,则H是氢气;F是无色气体,其中F有刺激性气味,D是黄色液体,因此D是硫,F是二氧化硫,G是紫黑色固体能够产生氧气,因此G是高锰酸钾,带入验证符合转化关系,因此:
(1)G是高锰酸钾,A是过氧化氢溶液;故填:高锰酸钾;过氧化氢溶液;
(2)C→B+H,即水在通电条件下生成氢气和氧气,B+D→F,即硫和氧气反应生成二氧化硫,
故填:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑;S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2;
(3)化合反应的特点是“多变一”,因此只有硫和氧气的反应,而过氧化氢分解、高锰酸钾分解、水分解都是分解反应;故填:1.
点评 本题难度不大,解题时往往需要从题目中挖出一些明显或隐含的条件,抓住突破口(突破口往往是现象特征、反应特征等),获得结论,最后把结论代入原题中验证.

练习册系列答案
相关题目
1.如图所示实验装置或实验操作正确的是( )
| A. |  除去一氧化碳中的二氧化碳 | B. |  稀释浓硫酸 | ||
| C. |  氢气与氧化铜反应装置 | D. |  加热蒸发氯化钠溶液 |
2.某兴趣小组话动中,在空气中点燃镁条时,发现在生成的白色固体物质中夹杂着少量的淡黄色固体.为了探究其原因,小组成员进行了以下探究活动:
【提出问题】淡黄色固体物质的成分是什么?
【查阅资料】通过查阅资料,记录了下列几种物质的颜色:
小组成员一致认为产物中一定不含有氯化镁,理由是空气中无氯元素或空气中无氯气
【提出猜想】淡黄色的固体可能是Mg3N2.(填化学式)
【实验探究】(1)按如图所示装置收集氮气(关闭a、b、c,用凸透镜聚光引燃白磷,待白磷不再燃烧并冷却至室温后,打开a、b、c,使用打气筒进行充气)

(2)C装置收集氮气的原因是除去装置B中的氧气
【实验结论】猜想是正确的.
【实验反思】本探究活动对物质燃烧新的认识是燃烧不一定都需要氧气 或 氮气也能支持燃烧.
【提出问题】淡黄色固体物质的成分是什么?
【查阅资料】通过查阅资料,记录了下列几种物质的颜色:
小组成员一致认为产物中一定不含有氯化镁,理由是空气中无氯元素或空气中无氯气
【提出猜想】淡黄色的固体可能是Mg3N2.(填化学式)
| 物质 | MgO | MgCl2 | Mg3N2 | Mg(NO3)2 | MgCO3 | Mg(OH)2 |
| 颜色 | 白色 | 白色 | 淡黄色 | 白色 | 白色 | 白色 |

(2)C装置收集氮气的原因是除去装置B中的氧气
【实验结论】猜想是正确的.
【实验反思】本探究活动对物质燃烧新的认识是燃烧不一定都需要氧气 或 氮气也能支持燃烧.
16.洗发产品中含有的柠檬酸(C6H8O7)能使头发柔顺有弹性.下列有关说法中正确的是( )
| A. | 柠檬酸属于氧化物 | B. | 柠檬酸含有6个碳元素 | ||
| C. | 柠檬酸中氧元素的质量分数最大 | D. | 柠檬酸中含有氧气 |
20. 碳酸钙可用于预防和治疗钙缺乏症.某实验小组同学要测定一种钙片中碳酸钙的含量.
碳酸钙可用于预防和治疗钙缺乏症.某实验小组同学要测定一种钙片中碳酸钙的含量.
【查阅资料】获得的资料有:
(1)补钙剂中常加入糖类、维生素D等改善口感或增强药效.这些物质不与稀盐酸反应产生气体,高温灼烧时会燃烧或分解,有二氧化碳生成.
(2)碳酸钙高温灼烧分解生成氧化钙和二氧化碳.
(3)常见的碳酸钙含量测定方法:将碳酸钙粉碎,加入已知浓度的过量盐酸充分反应,然后测剩余盐酸的量,根据消耗盐酸的量最终求得碳酸钙的含量.
(4)澄清石灰水中的Ca(OH)2含量很少,100g澄清石灰水中最多含0.15g Ca(OH)2.
【方案设计和实施】根据资料和已学知识,该小组同学设计如下两种方案进行测定.
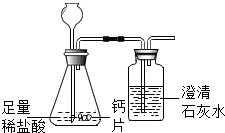
方案1:根据右图所示装置实验.
(1)锥形瓶中发生反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)长颈漏斗下部插入液面下的目的是防止二氧化碳气体溢出.
(3)加入药品前,检验该装置气密性的方法是夹住胶管(堵住导管出口),从长颈漏斗加水至长颈漏斗中液面高于锥形瓶内液面,若一段时间不下降,则证明该装置气密性良好.
(4)记录数据如下:
方案2:将钙片粉碎,加入足量的稀盐酸充分反应,根据放出气体的量计算碳酸钙的含量.记录数据如下(空烧杯质量为100g,加入钙片质量为25g):
【分析和评价】
(1)方案1和方案2中合理的是方案2,原因是澄清石灰水中的Ca(OH)2含量很少(不足),吸收的二氧化碳量很少.
(2)该小组同学没有使用碳酸钙高温灼烧分解的方法(实验室可以进行该实验),原因是加入的糖类、维生素D等物质高温灼烧时会燃烧或分解,导致最终的数据偏大.
(3)要使用【查阅资料】(3)中介绍的方法,还需要学习的是如何测定未知浓度(剩余)盐酸的量.
【结论】经过计算,该钙片中碳酸钙的质量分数是60%.
 碳酸钙可用于预防和治疗钙缺乏症.某实验小组同学要测定一种钙片中碳酸钙的含量.
碳酸钙可用于预防和治疗钙缺乏症.某实验小组同学要测定一种钙片中碳酸钙的含量.【查阅资料】获得的资料有:
(1)补钙剂中常加入糖类、维生素D等改善口感或增强药效.这些物质不与稀盐酸反应产生气体,高温灼烧时会燃烧或分解,有二氧化碳生成.
(2)碳酸钙高温灼烧分解生成氧化钙和二氧化碳.
(3)常见的碳酸钙含量测定方法:将碳酸钙粉碎,加入已知浓度的过量盐酸充分反应,然后测剩余盐酸的量,根据消耗盐酸的量最终求得碳酸钙的含量.
(4)澄清石灰水中的Ca(OH)2含量很少,100g澄清石灰水中最多含0.15g Ca(OH)2.
【方案设计和实施】根据资料和已学知识,该小组同学设计如下两种方案进行测定.
方案1:根据右图所示装置实验.
(1)锥形瓶中发生反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)长颈漏斗下部插入液面下的目的是防止二氧化碳气体溢出.
(3)加入药品前,检验该装置气密性的方法是夹住胶管(堵住导管出口),从长颈漏斗加水至长颈漏斗中液面高于锥形瓶内液面,若一段时间不下降,则证明该装置气密性良好.
(4)记录数据如下:
| 钙片质量 | 空洗气瓶质量 | 澄清石灰水的质量 | 反应后洗气瓶及瓶内物质总质量 |
| 25g | 100g | 200g | 300.4g |
| 加入稀盐酸的质量 | 100g | 200g | 300g | 400g |
| 充分反应后烧杯及杯内物质总质量 | 222.8g | 320.6g | 418.4g | 518.4g |
(1)方案1和方案2中合理的是方案2,原因是澄清石灰水中的Ca(OH)2含量很少(不足),吸收的二氧化碳量很少.
(2)该小组同学没有使用碳酸钙高温灼烧分解的方法(实验室可以进行该实验),原因是加入的糖类、维生素D等物质高温灼烧时会燃烧或分解,导致最终的数据偏大.
(3)要使用【查阅资料】(3)中介绍的方法,还需要学习的是如何测定未知浓度(剩余)盐酸的量.
【结论】经过计算,该钙片中碳酸钙的质量分数是60%.