题目内容
17.10g氯酸钾和2g二氧化锰的混合物加热,制取一定量的氧气后测知剩余固体中二氧化锰的质量分数为20%.请计算(1)剩余固体的质量
(2)反应掉的氯酸钾的质量.
分析 (1)根据二氧化锰在该反应中作催化剂,反应前后质量不变,由二氧化锰的质量和剩余固体中二氧化锰的质量分数,可以计算出剩余固体的质量.
(2)根据质量守恒定律原氯酸钾和二氧化锰的质量和与剩余固体的质量之差即为生成的氧气的质量,利用氧气的质量求出反应掉的氯酸钾的质量即可.
解答 解:(1)剩余固体的质量为:2g÷20%=10g;
(2)生成氧气的质量为:10g+2g-10g=2g;
设生成2克氧气需要KClO3的质量是x.
2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑
245 96
x 2g
$\frac{245}{x}=\frac{96}{2g}$
得:x=5.1g
答:(1)剩余固体的质量为10g;
(2)反应掉的氯酸钾的质量为5.1g.
点评 本题主要考查质量守恒定律,固体反应前后减少的质量为生成氧气的质量是解决此题的关键.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
2.某一黑色固体,可能是木炭,也可能是氧化铜,也有可能是木炭和氧化铜的混合物.请你设计实验,证明黑色固体究竟是什么物质?(完成下面表格的填空)
| 你的猜想 | 实验步骤 | 实验现象 | 结论 |
| (1)黑色固体可能是木炭粉 (2)黑色固体可能 | 取少量的黑色粉末放入烧杯中,加入足量的稀硫酸搅拌 | (1)黑色固体没有减少,溶液为无色 (2)黑色固体完全消失,溶液变为蓝色 (3)黑色固体部分消失,溶液变为蓝色 | (1)该黑色固体是木炭粉 (2)该黑色固体是氧化铜 (3)该黑色固体是氧化铜 和木炭粉的混合物 |
18.用分子的观点对下列现象解释错误的是( )
| A. | 花香四溢--分子在不断运动 | B. | 酿制美酒--分子本身发生改变 | ||
| C. | 空气液化--分子间间隔改变 | D. | 汽油挥发--分子体积变大 |

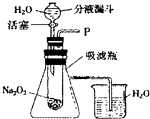 “在学校的元旦联欢会上,某同学表演了‘水能生火’的魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来了.”
“在学校的元旦联欢会上,某同学表演了‘水能生火’的魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来了.”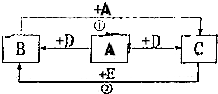 如图,A、B、C、D、E均是初中化学的常见物质,A、B、C均含有同一种元素.变化②的现象是颜色由红变黑,相应变化的生成物没有全部列出,各变化的条件也未标出.回答下列问题:
如图,A、B、C、D、E均是初中化学的常见物质,A、B、C均含有同一种元素.变化②的现象是颜色由红变黑,相应变化的生成物没有全部列出,各变化的条件也未标出.回答下列问题: