题目内容
13.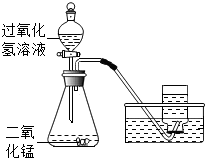 如图所示,实验室用过氧化钠溶液和二氧化锰制取氧气,实验的相关数据如下表.
如图所示,实验室用过氧化钠溶液和二氧化锰制取氧气,实验的相关数据如下表.(1)反应生成氧气的质量(结果精确到0.1g,下同).
(2)参加反应的过氧化氢的质量.
| 气体发生装置内物质的总质量 | |
| 反应前 | 35.6 |
| 反应后 | 34.8 |
分析 (1)根据质量守恒定律可以知道反应前后减少的质量即为生成氧气的质量,可以据此解答;
(2)根据生成氧气的质量结合过氧化氢分解的化学方程式可以求算出过氧化氢的质量.
解答 】解:(1)根据质量守恒定律可以知道反应前后减少的质量即为生成氧气的质量,即为:35.6g-34.8g=0.8g;
(2)设参加反应的过氧化氢的质量为x
2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
68 32
x 0.8g
$\frac{68}{x}=\frac{32}{0.8g}$
解得:x=1.7g
答:(1)反应生成氧气的质量为0.8g;(2)参加反应的过氧化氢的质量为1.7g.
点评 要想解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等.然后,根据所给的问题情景结合所学的相关知识和技能,细致地分析题意并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.

练习册系列答案
相关题目
1.人类和日常生活离不开谁,下列做法中,不利于节约用水的是( )
| A. | 用淘米水浇花 | B. | 洗碗筷时用水盆盛水清洗 | ||
| C. | 园林工人采用滴灌的方式浇灌花草 | D. | 洗手打肥皂时不关水龙头 |
8.日常生活中发生的下列变化都属于化学变化的一组是( )
| A. | 玻璃杯摔碎,米饭变馊 | B. | 菜刀生锈,牛奶变酸 | ||
| C. | 乒乓球变瘪,蜡烛燃烧 | D. | 酒精挥发,湿衣服晾干 |
18.如图表示治理汽车尾气所涉及反应的微观过程.下列说法不正确的是( )

| A. | 图中单质的化学式为N2 | B. | 反应使有害气体转化为无害气体 | ||
| C. | 反应前后原子个数相等 | D. | 生成单质与化和物的质量比为7:21 |
2. 如图是KNO3和NaCl的溶解度曲线.下列说法中正确的是( )
如图是KNO3和NaCl的溶解度曲线.下列说法中正确的是( )
 如图是KNO3和NaCl的溶解度曲线.下列说法中正确的是( )
如图是KNO3和NaCl的溶解度曲线.下列说法中正确的是( )| A. | NaCl的溶解度不受温度的影响 | |
| B. | t1℃时,100gKNO3饱和溶液中含有20gKNO3 | |
| C. | t2℃时,NaCl饱和溶液与KNO3饱和溶液中溶质的质量一定相等 | |
| D. | 温度高于t2℃时,KNO3的溶解度大于NaCl的溶解度 |
3.下图是过滤器的制作和过滤装置图,则下列有关说法错误的是( )


| A. | 图中制过滤器时加水湿润,是为了使滤纸能紧贴漏斗内壁 | |
| B. | 过滤时,待滤液不能高于滤纸的边缘 | |
| C. | 玻璃棒应轻靠在三层滤纸一边 | |
| D. | 过滤过程中玻璃棒的作用是搅拌,加快过滤速度 |
