题目内容
10.金属是人类生活中的常用的材料.
(1)下列生活用品中,主要利用金属导热性的是AB(填字母序号).
(2)工业上用赤铁矿(主要成分是氧化铁)冶炼铁的化学方程式是3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(3)现有锌片、铜片、铁片,硫酸亚铁溶液、硫酸锌溶液和硫酸铜溶液5种物质,某同学欲探究锌,铁和铜的金属活动性顺序,选择的一组试剂是(只能选三种)铁片,硫酸锌溶液和硫酸铜溶液,其现象是铁片表面有红色物质析出,溶液由蓝色变为无色.
分析 (1)根据金属制品的用途分析性质;
(2)根据炼铁的原理写出反应的化学方程式;
(3)要设计实验验证金属的活动性强弱,可以依据金属活动性顺序的意义进行,根据金属与盐溶液的反应特点进行分析解答即可.
解答 解:(1)金属具有良好的导热性,可以用来制作炊具,所以,主要利用金属导热性的是AB;
(2)一氧化碳具有还原性,能与氧化铁反应生成铁和二氧化碳,所以工业上用赤铁矿(主要成分是氧化铁)冶炼铁的化学方程式是:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(3)欲探究锌,铁和铜的金属活动性顺序,可以利用金属与盐溶液能否反应来进行选择药品.由于三种的金属的活动性大小是锌>铁>铜,可以利用”三取中“的方法,所以选择的一组试剂是铁片,硫酸锌溶液和硫酸铜溶液,反应的现象是:铁片表面有红色物质析出,溶液由蓝色变为无色.
故答为:(1)AB;(2)3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;铁片,硫酸锌溶液和硫酸铜溶液 铁片表面有红色物质析出,溶液由蓝色变为无色
点评 本题考查了常见金属的应用,完成此题,可以依据金属的性质进行.

练习册系列答案
相关题目
1.刚刚结束的全国两会与3月15日胜利闭幕,其中环保是今年两会的关注问题之一,建设社会主义新农村的新目标之一是让农民饮用清洁的自来水.自来水消毒过程中常会发生甲、乙化学反应,其反应的微观过程可用如图表示.下列说法正确的是( )


| A. | 物质D属于氧化物 | B. | 物质C的水溶液pH大于7 | ||
| C. | 甲属于复分解反应 | D. | 实验室可用H2O2和MnO2制取E |
18.一瓶久置的氢氧化钠固体已经发生了变质.某研究性学习小组为了探究变质程度,作出如下猜想:可能部分变质,固体是NaOH和 Na2CO3的混合物;可能全部变质,固体是Na2CO3.
(1)首先对固体的成分进行确定.取少量固体于试管中,加水充分溶解,先加入足量的BaCl2 溶液,产生白色沉淀,静置后取上层清液,再加入CuSO4 溶液,产生蓝色絮状沉淀.根据实验现象,可确定该固体是NaOH和Na2CO3混合物;
(2)称取10.6g 该固体样品于锥形瓶中,加入一定质量分数的稀盐酸,直至过量,得到数据如表:
计算该样品中Na2CO3的质量分数(写出计算过程).
(3)再取固体样品溶于水,加入一定质量分数的稀盐酸,直至过量.测出加入稀盐酸的质量与产生CO2气体的质量关系如图所示. 请你分析,一定质量的NaOH固体,变质前后与相同质量分数的稀盐酸反应,变质前消耗盐酸的量等于变质后消耗盐酸的量(填“大于”、“小于”或“等于”).

(1)首先对固体的成分进行确定.取少量固体于试管中,加水充分溶解,先加入足量的BaCl2 溶液,产生白色沉淀,静置后取上层清液,再加入CuSO4 溶液,产生蓝色絮状沉淀.根据实验现象,可确定该固体是NaOH和Na2CO3混合物;
(2)称取10.6g 该固体样品于锥形瓶中,加入一定质量分数的稀盐酸,直至过量,得到数据如表:
| 样品质量 | 反应前总质量 | 反应后总质量 |
| 10.6克 | 148.5克 | 146.3克 |
(3)再取固体样品溶于水,加入一定质量分数的稀盐酸,直至过量.测出加入稀盐酸的质量与产生CO2气体的质量关系如图所示. 请你分析,一定质量的NaOH固体,变质前后与相同质量分数的稀盐酸反应,变质前消耗盐酸的量等于变质后消耗盐酸的量(填“大于”、“小于”或“等于”).
5.由下列实验可推知金属正确的活泼性顺序为( )
①X,Y,Z三种金属分别放入到稀盐酸中,只有X表面产生气泡,Y,Z表面均无气泡产生.
②把Z放入到含有Y的硝酸盐溶液中,Z表面有Y析出.
①X,Y,Z三种金属分别放入到稀盐酸中,只有X表面产生气泡,Y,Z表面均无气泡产生.
②把Z放入到含有Y的硝酸盐溶液中,Z表面有Y析出.
| A. | X>Y>Z | B. | X>Z>Y | C. | Y>Z>X | D. | Z>Y>X |
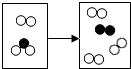 如图是密闭体系中某反应的微观示意图,“
如图是密闭体系中某反应的微观示意图,“ ”和“
”和“ ”分别表示微粒.
”分别表示微粒. B、
B、 C、
C、 D、
D、
