题目内容
20.甲醇的化学式为CH3OH,辛烷是石油的主要成分,化学式为C9H18,它们燃烧的产物都是水和二氧化碳,请利用质量守恒定律解释,为什么甲醇和辛烷燃烧产物的种类相同但质量比却不同?分析 根据质量守恒定律,化学反应前后元素的种类质量不变来解释即可.
解答 解:甲醇和辛烷燃烧的反应物的组成元素都是碳、氢、氧,根据质量守恒定律可知,它们燃烧的产物都是水和二氧化碳;两者完全然后后碳元素完全进入二氧化碳,氢元素完全进入水,因为甲醇中碳、氢元素的质量比和辛烷中碳、氢元素的质量比不同,因此生成二氧化碳和水的质量比不同.
答:甲醇和辛烷燃烧的反应物的组成元素都是碳、氢、氧,根据质量守恒定律可知,它们燃烧的产物都是水和二氧化碳;两者完全然后后碳元素完全进入二氧化碳,氢元素完全进入水,因为甲醇中碳、氢元素的质量比和辛烷中碳、氢元素的质量比不同,因此生成二氧化碳和水的质量比不同.
点评 本题考查了质量守恒定律的应用;在发生化学反应前后元素的种类和质量是不变的.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
8.区别下列物质所用试剂或方法错误的是( )
| A. | 铜与铜锌合金──稀盐酸 | B. | 硬水与软水──肥皂水 | ||
| C. | N2与CO2──燃着的木条 | D. | 水与澄清石灰水──CO2 |
5.随着我国航天科技的迅速发展,探测火星已成为我国航空科技发展的远景目标,但要把人送上火星,还有许多航天技术问题需要解决,如:如何提供往返路程中宇航员呼吸所需的氧气和消除呼吸过程中产生的二氧化碳就是一个值得研究的问题.已知一个成年人平均每年要呼吸空气6.57X106L左右,飞船飞往火星来回一趟需要两年时间,若飞船上有三名宇航员,则飞船发射时携带的全部所需的氧气约为11838kg,这个数量很大,将大大提高发射成本和难度.
(1)有人提出在飞船上供氧的两个方案:
①通过太阳能电池产生的电流来电解水;
②通过下列化学反应产生氧气:2Na2O2+2CO2═2Na2CO3+O2从减轻飞船发射重量和消除呼吸过程产生的二氧化碳的角度请你评价这两个方案最主要的优缺点(各写一点).
(2)也有科学家提出研究使宇航人工冬眠技术加快飞船速度,缩短航行时间来减少氧气的携带量.你是否有较好的方案,请举一例在飞船内种植光合作用效率高的绿色植物;你提出该方案的简单理由是既能够消耗二氧化碳,又能够产生氧气,同时能够减轻飞船发射重量.
(1)有人提出在飞船上供氧的两个方案:
①通过太阳能电池产生的电流来电解水;
②通过下列化学反应产生氧气:2Na2O2+2CO2═2Na2CO3+O2从减轻飞船发射重量和消除呼吸过程产生的二氧化碳的角度请你评价这两个方案最主要的优缺点(各写一点).
| 方案 | 优点 | 缺点 |
| ① | 能够减轻飞船发射重量 | 不能消除呼吸过程产生的二氧化碳 |
| ② | 能够消除呼吸过程产生的二氧化碳 | 不能减轻飞船发射重量 |
9.控制化学反应的条件可以促进或抑制化学反应,更好地使化学反应为人类造福.
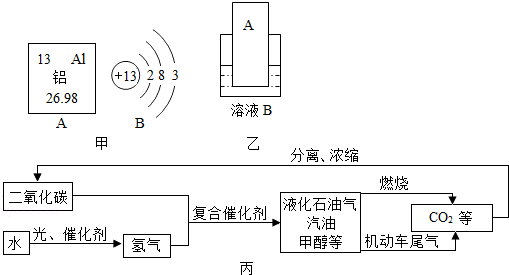
(1)元素周期表中铝元素的信息如图甲所示,其相对原子质量为26.98.化学反应中该原子容易失去(填“得到”或“失去”)电子;
(2)Al-30书写形式和数字含义与C-12相似(12表示相对原子质量),则Al-30的中子数为17.
(3)铝制品在生活中因耐用而应用越来越广泛,主要原因是常温下,铝制品表面会有一层致密的氧化膜,阻止铝进一步被氧化.
(4)运载“嫦娥三号”的火箭外壳用到了钛合金,钛合金属于混合物(填“混合物”或“纯净物”).
(5)要通过图乙实验得出铝和铜的金属活动性顺序,如果B是硫酸铜溶液,则金属A是Al(填化学式),如果A是铜,则溶液B中溶质的名称是硫酸铝.
(6)中国高铁迅速发展,截止2014年12月26日,中国高铁运营总里程超过15000公里,约占世界高铁运营里程的50%,稳居世界榜首.在焊接钢轨等大截面钢材部件时会利用铝热反应,其化学方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒,有熔融物生成”.查阅资料知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
该同学推测,铝热反应所得到的熔融物应是铁铝合金.这种推测有一定的道理,理由是:该反应温度下铝已熔化,未反应的铝与生成的铁熔合在一起.
(7)月球富含钛铁矿,主要成分是钛酸亚铁(FeTiO3),其中钛(Ti)的化合价是+4 .
材料一:2014年5月27日,中国中航工业航材院相关人士向《环球时报》透露,他们成功利用石墨烯与铝合金在全球率先研制出“烯合金”,宣布具有特殊性能的系列材料问世.这一成果,或许将对航空航天器带来革命性变革.
材料二:石墨烯是从石墨中分离出来的单层石墨片,在室温下可以单独稳定存在,具有优异的导电、导热性能.
(8)写出石墨烯在空气中完全燃烧的化学反应方程式C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2.
(9)将适量的烯合金放入足量稀硫酸中,在烯合金的表面产生大量气泡,请写出该反应的化学方程式2Al+3H2SO4=Al2(SO4)3+3H2↑.
(10)如图丙是科学家正在研究的二氧化碳循环利用技术,①二氧化碳与氢气在催化剂、高温条件下,除生成甲醇(CH4O)外,还生成一种常温下为液态的化合物,写出反应的化学方程式CO2+3H2$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$CH4O+H2O .
②尿素[CO(NH2)2]对提高粮食产量具有重要的作用.人们控制条件可以使CO2和物质X发生反应:CO2+2X═CO(NH2)2+H2O,物质X的化学式为NH3.

(1)元素周期表中铝元素的信息如图甲所示,其相对原子质量为26.98.化学反应中该原子容易失去(填“得到”或“失去”)电子;
(2)Al-30书写形式和数字含义与C-12相似(12表示相对原子质量),则Al-30的中子数为17.
(3)铝制品在生活中因耐用而应用越来越广泛,主要原因是常温下,铝制品表面会有一层致密的氧化膜,阻止铝进一步被氧化.
(4)运载“嫦娥三号”的火箭外壳用到了钛合金,钛合金属于混合物(填“混合物”或“纯净物”).
(5)要通过图乙实验得出铝和铜的金属活动性顺序,如果B是硫酸铜溶液,则金属A是Al(填化学式),如果A是铜,则溶液B中溶质的名称是硫酸铝.
(6)中国高铁迅速发展,截止2014年12月26日,中国高铁运营总里程超过15000公里,约占世界高铁运营里程的50%,稳居世界榜首.在焊接钢轨等大截面钢材部件时会利用铝热反应,其化学方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒,有熔融物生成”.查阅资料知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2990 | 2750 | -- |
(7)月球富含钛铁矿,主要成分是钛酸亚铁(FeTiO3),其中钛(Ti)的化合价是+4 .
材料一:2014年5月27日,中国中航工业航材院相关人士向《环球时报》透露,他们成功利用石墨烯与铝合金在全球率先研制出“烯合金”,宣布具有特殊性能的系列材料问世.这一成果,或许将对航空航天器带来革命性变革.
材料二:石墨烯是从石墨中分离出来的单层石墨片,在室温下可以单独稳定存在,具有优异的导电、导热性能.
(8)写出石墨烯在空气中完全燃烧的化学反应方程式C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2.
(9)将适量的烯合金放入足量稀硫酸中,在烯合金的表面产生大量气泡,请写出该反应的化学方程式2Al+3H2SO4=Al2(SO4)3+3H2↑.
(10)如图丙是科学家正在研究的二氧化碳循环利用技术,①二氧化碳与氢气在催化剂、高温条件下,除生成甲醇(CH4O)外,还生成一种常温下为液态的化合物,写出反应的化学方程式CO2+3H2$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$CH4O+H2O .
②尿素[CO(NH2)2]对提高粮食产量具有重要的作用.人们控制条件可以使CO2和物质X发生反应:CO2+2X═CO(NH2)2+H2O,物质X的化学式为NH3.


 A、B、C均为初中化学常见纯净物,它们之间的转化关系如图所示(图中“→”表示物质间存
A、B、C均为初中化学常见纯净物,它们之间的转化关系如图所示(图中“→”表示物质间存