题目内容
11.CO2是造成温室效应增强的主要气体,CO2在催化剂、230℃、压力为5-10MPa等条件下与氢气反应来制备甲醇等物质,被认为是目前短期间内固定大量排放CO2的既经济又有效的方法之一.“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来并利用,能有效地减少CO2气体的排放.如可利用NaOH溶液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出).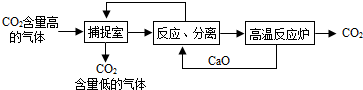
根据以上信息判断,分析完成以下问题.
(1)请写出工业上用CO2制备甲醇的化学方程式为:CO2+3H2$\frac{\underline{\;\;\;催化剂\;\;\;}}{高温高压}$CH4O+H2O;
(2)下列有关“碳捕捉技术”方法的叙述中正确的是D;
A.能耗不大是该方法的一大优点
B.整个过程中,只有一种物质可以循环利用
C.“反应分离”环节中,分离物质的基本操作是蒸发结晶
D.该方法可以减少碳排放,捕捉到的CO2还可以用来制备甲醇等产品
(3)甲醇是重要化工原料和石油补充替代合成燃料,通过加氢将CO2转化为甲醇的研究倍受关注,但工业上用CO2制备甲醇目前尚未得以推广使用,请你根据所学的知识,从经济、环境或生产工艺等角度,提出实现大规模工业化生产需要解决的关键环节(请列出两条).
①解决能耗大问题;
②解决氢源限制问题.
分析 (1)根据二氧化碳和氢气在高温高压催化剂的条件下生成甲醇和水进行分析;
(2)根据各物质之间的反应进行分析;
(3)根据该反应的能耗大和氢气的制备、运输、储存等问题进行分析.
解答 解:(1)二氧化碳和氢气在高温高压催化剂的条件下生成甲醇和水,化学方程式为:CO2+3H2$\frac{\underline{\;\;\;催化剂\;\;\;}}{高温高压}$CH4O+H2O;
(2)A、该反应需要的条件是高温高压,能耗较大,故A错误;
B、整个过程中,氧化钙、二氧化碳都可以循环使用,故B错误;
C、“反应分离”环节中,分离物质的基本操作是过滤,故C错误;
D、该方法可以减少碳排放,捕捉到的CO2还可以用来制备甲醇等产品,故D正确.
故选:D;
(3)该反应中存在的问题能耗大和氢气的制备、运输、储存等,所以解决能耗大问题;解决氢源限制问题.
故答案为:(1)CO2+3H2$\frac{\underline{\;\;\;催化剂\;\;\;}}{高温高压}$CH4O+H2O;
(2)D;
(3)解决能耗大问题;解决氢源限制问题;寻找优良催化剂等问题;获得高纯度CO2.
点评 在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中所给的知识进行解答.

练习册系列答案
相关题目
1.(1)人们使用天然气(主要成分为甲烷)过程中要注意通风,如果氧气不足会产生一氧化碳,使人中毒.某兴趣小组在实验室利用下列实验装置,在老师指导下制取氧气和甲烷,并检验甲烷燃烧后的气体产物.
①小王用加热无水醋酸钠和碱石灰固体中的氢氧化钠反应生成甲烷,发生装置应选择图1中的A(填字母).

②小李用一定溶质质量分数的过氧化氢溶液和二氧化锰固体制取并收集一瓶干燥的氧气,请从图1选择装置图,正确的组装顺序为CFD(填字母),反应方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
③下面是小张对甲烷在氧气中燃烧后的气体产物进行验证的实验.(图2)(假定每步均完全反应)请完成实验报告:

(2)请你参与鉴别澄清石灰水和氢氧化钠溶液的实验操作题.
[提出问题]如何鉴别两种无色溶液?
[实验方案]小林等几位同学进行了如图3所示的实验.请你回答下列问题:

①C组实验中反应的化学方程式为Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
②其中不能达到实验目的是A、B(填字母);
③D组实验中变浑浊的原溶液是澄清石灰水或Ca(OH)2溶液.
[继续探究]实验结束后,小林同学将A、B、C、D四组试管中的物质全部倒入同一个干净的烧杯中,充分反应后,得到无色澄清透明的溶液,对该溶液的成分又进行了探究.
[提出问题]该溶液中除水、酚酞外还含有哪些物质?
[查阅资料]氯化钙溶液呈中性.
[猜想与假设]Ⅰ.NaCl、CaCl2Ⅱ.NaCl、CaCl2Ⅲ.NaCl、CaCl2、NaOH
[反思与拓展]上述猜想与假设中只有一个不成立,它是Ⅲ(填序号).
①小王用加热无水醋酸钠和碱石灰固体中的氢氧化钠反应生成甲烷,发生装置应选择图1中的A(填字母).

②小李用一定溶质质量分数的过氧化氢溶液和二氧化锰固体制取并收集一瓶干燥的氧气,请从图1选择装置图,正确的组装顺序为CFD(填字母),反应方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
③下面是小张对甲烷在氧气中燃烧后的气体产物进行验证的实验.(图2)(假定每步均完全反应)请完成实验报告:

| 实验操作 | 实验现象 | 实验结论 |
| 将燃烧后气体产物进行验证 | 甲中的白色固体变蓝 | 燃烧产物中有H2O |
| 乙装置质量增加 | 燃烧产物中有CO2,乙瓶中反应方程式2NaOH+CO2═Na2CO3+H2O | |
| 丁中玻璃管内固体红色变成黑色、戊中石灰水变浑浊 | 燃烧产物中有CO,丁中玻璃管内反应方程式 Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 |
[提出问题]如何鉴别两种无色溶液?
[实验方案]小林等几位同学进行了如图3所示的实验.请你回答下列问题:

①C组实验中反应的化学方程式为Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
②其中不能达到实验目的是A、B(填字母);
③D组实验中变浑浊的原溶液是澄清石灰水或Ca(OH)2溶液.
[继续探究]实验结束后,小林同学将A、B、C、D四组试管中的物质全部倒入同一个干净的烧杯中,充分反应后,得到无色澄清透明的溶液,对该溶液的成分又进行了探究.
[提出问题]该溶液中除水、酚酞外还含有哪些物质?
[查阅资料]氯化钙溶液呈中性.
[猜想与假设]Ⅰ.NaCl、CaCl2Ⅱ.NaCl、CaCl2Ⅲ.NaCl、CaCl2、NaOH
[反思与拓展]上述猜想与假设中只有一个不成立,它是Ⅲ(填序号).
2.下列说法正确的是( )
| A. | 工业生产中都可以使用硬水 | B. | 实验剩余药品放回原瓶 | ||
| C. | 洗洁精能除去餐具上的油污 | D. | 回收地沟油,用作食用油 |
19. 如图是A、B两种固体物质的溶解度曲线,下列说法错误的是( )
如图是A、B两种固体物质的溶解度曲线,下列说法错误的是( )
 如图是A、B两种固体物质的溶解度曲线,下列说法错误的是( )
如图是A、B两种固体物质的溶解度曲线,下列说法错误的是( )| A. | 20℃时,A、B两种物质的溶解度相等 | |
| B. | B物质的饱和溶液从30℃降温到10℃,变成不饱和溶液 | |
| C. | 30℃时,A的饱和溶液中溶质质量分数大于B的饱和溶液中溶质质量分数 | |
| D. | 若A中含有少量的B,可用冷却热饱和溶液的方法提纯A |
6.下列实验操作中,不正确的是( )
| A. | 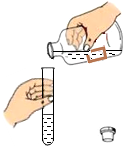 倾倒液体 | B. | 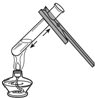 加热液体 | C. | 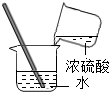 稀释浓硫酸 稀释浓硫酸 | D. |  检查气密性 |
3.物质的性质决定物质的用途.下列物质的用途中,利用其化学性质的是( )
①氮气作保护气;②铝用作导线;③浓硫酸作干燥剂;④小苏打用于焙制糕点;⑤氢氧化钠用于除油污.
①氮气作保护气;②铝用作导线;③浓硫酸作干燥剂;④小苏打用于焙制糕点;⑤氢氧化钠用于除油污.
| A. | ①④⑤ | B. | ①②③ | C. | ①③④ | D. | ②③⑤ |
20.氧元素在元素周期表中的信息如图所示,下列说法不正确的是( )


| A. | 氧元素属于非金属元素 | B. | 氧原子的核外电子数为8 | ||
| C. | 氧原子的核电荷数为8 | D. | 氧元素的原子序数为16 |