题目内容
5.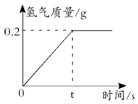 李明同学通过查阅资料得知钠与冷水可发生剧烈反应,并生成氢气和氢氧化钠.在一节实验课上,老师从实验室取了4.6g的钠与一盆质量为5kg的冷水,将钠放入水中后同学们观察到水中有气体产生,且生成的气体的质量与时间的关系如图所示,求:
李明同学通过查阅资料得知钠与冷水可发生剧烈反应,并生成氢气和氢氧化钠.在一节实验课上,老师从实验室取了4.6g的钠与一盆质量为5kg的冷水,将钠放入水中后同学们观察到水中有气体产生,且生成的气体的质量与时间的关系如图所示,求:(1)反应结束后生成氢气的质量为0.2g;
(2)计算氢氧化钠溶液的溶质质量分数.(结果保留到0.1%)
分析 钠和水反应生成氢氧化钠和氢气,根据反应的化学方程式及其提供的数据可以进行相关方面的计算和判断.
解答 解:(1)由图中信息可知,反应结束后生成氢气的质量是0.2g.
故填:0.2.
(2)设反应生成氢氧化钠的质量为x,
2Na+2H2O=2NaOH+H2↑,
80 2
x 0.2g
$\frac{80}{x}$=$\frac{2}{0.2g}$,
x=8g,
氢氧化钠溶液的溶质质量分数为:$\frac{8g}{4.6g+5000g-0.2g}$×100%=0.2%,
答:氢氧化钠溶液的溶质质量分数为0.2%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
16.某同学做了如下图所示实验并对实验数据和现象记录如下表,请回答下列问题: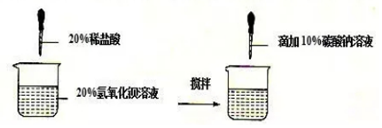
(1)写出第一次实验中加入盐酸后发生反应的化学方程式2HCl+Ba(OH)2═BaCl2+2H2O.
(2)第一次实验结束后所得溶液中溶质的化学式为NaCl和NaOH.
(3)根据已知条件求解出第二次实验生成白色沉淀X的比例式$\frac{106}{21.2g}=\frac{197}{X}$.
(4)第二次实验中每一步所加物质均恰好完全反应
(5)若向第二次的溶液中加入51.4g水,则所得不饱和溶液中溶质的质量分数为5%.
(6)若配制实验中需要的稀盐酸,需用36.5%的浓盐酸的质量为140g.

| 实验次数 | 第一次 | 第二次 | 第三次 |
| 氢氧化钡溶液质量 | 171g | 171g | 171g |
| 滴加盐酸的质量 | 36.5g | 73g | 146g |
| 滴加碳酸钠溶液质量 | 212g | 212g | 212g |
(2)第一次实验结束后所得溶液中溶质的化学式为NaCl和NaOH.
(3)根据已知条件求解出第二次实验生成白色沉淀X的比例式$\frac{106}{21.2g}=\frac{197}{X}$.
(4)第二次实验中每一步所加物质均恰好完全反应
(5)若向第二次的溶液中加入51.4g水,则所得不饱和溶液中溶质的质量分数为5%.
(6)若配制实验中需要的稀盐酸,需用36.5%的浓盐酸的质量为140g.
13.翡翠,是硬玉的一种,主要成分为NaAlSi2O6,是生活中常见的一种饰品和收藏品.下列有关翡翠主要成分的说法不正确的是( )
| A. | 该物质是由四种元素组成 | |
| B. | 该物质属于化合物 | |
| C. | 该物质中钠、铝、硅、氧原子个数比为1:1:2:6 | |
| D. | 该物质中Si元素化合价为+3价 |
20.许多化学概念在逻辑上存在着包含、并列或交叉的关系,如图所示,下列有关概念间的关系的说法正确的是( )


| A. | 酸和碱属于并列关系 | B. | 单质和化合物属于包含关系 | ||
| C. | 纯净物和混合物属于交叉关系 | D. | 燃烧和爆炸属于包含关系 |
17.下列现象中,能够说明铝的金属活动性比铁强的是( )
| A. | 铝可以从硫酸亚铁溶液中置换出铁 | |
| B. | 铝比铁不易生锈 | |
| C. | 等质量的铝和铁与足量酸反应时,铝放出的氢气多 | |
| D. | 纯铝的硬度比纯铁的硬度小 |
14.鉴别下列物品方法不正确的是( )
| 选项 | 鉴别的物质 | 鉴别的方法 |
| A | 冰和干冰 | 室温(20℃)放置,过一段观察是否有水渍 |
| B | 水和双氧水 | 加二氧化锰,观察是否有气泡 |
| C | 二氧化锰和氧化铜 | 观察颜色 |
| D | 纯羊毛和化纤面料 | 灼烧闻气味 |
| A. | A | B. | B | C. | C | D. | D |
