题目内容
11.下列物质中,属于纯净物的是( )| A. | 洁净的空气 | B. | 透明的汽水 | C. | 固态氧 | D. | 蓝色硫酸铜溶液 |
分析 本题考查利用纯净物的概念来判断物质是否为纯净物,宏观上看只有一种物质,微观上只有一种分子.
解答 解:A、洁净的空气中含有氧气、氮气、二氧化碳等物质,属于混合物,故A错;
B、透明的汽水中含有水、碳酸等物质,属于混合物,故B错;
C、固态氧是由氧气一种物质组成,属于纯净物,故C正确;
D、蓝色硫酸铜溶液中含有硫酸铜和水,属于混合物,故D错.
故选C.
点评 在熟悉概念的基础上能从宏观和微观两个方面来判断纯净物和混合物,还要从社会实践中了解生活中常见物质的组成.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
3.下列化学方程式、实验现象或用途都正确的是( )
| A. | S+O2═SO2在纯氧中燃烧,发出淡蓝色火焰 | |
| B. | 3H2SO4+2Fe═Fe2(SO4)3+3H2O 铁钉逐渐溶解,溶液由无色变成黄色 | |
| C. | Ca(OH)2+Na2CO3═CaCO3↓+NaOH 可用于工业上制备烧碱 | |
| D. | NaCl+AgNO3═AgCl↓+NaNO3可用于检验汗液中是否含有Cl- |
20.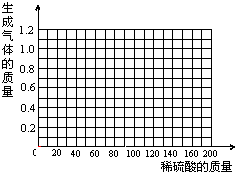 黄铜是一种重要的金属,它是铜和锌的合金,可用来制造机器、电器零件及日常用品.为了测定黄铜样品的组成,取五份样品分别加稀硫酸反应,其实验数据记录如下:
黄铜是一种重要的金属,它是铜和锌的合金,可用来制造机器、电器零件及日常用品.为了测定黄铜样品的组成,取五份样品分别加稀硫酸反应,其实验数据记录如下:
按要求回答下列问题:
(1)根据实验数据分析,从第4份开始,金属已经反应完全了.
(2)列式计算该黄铜样品中金属锌的质量分数.(要求写出计算过程)
(3)列式计算稀硫酸的溶质质量分数.(要求写出计算过程)
(4)在给出的坐标纸上,画出40.0g样品中加稀硫酸的质量与产生气体质量的关系曲线.
 黄铜是一种重要的金属,它是铜和锌的合金,可用来制造机器、电器零件及日常用品.为了测定黄铜样品的组成,取五份样品分别加稀硫酸反应,其实验数据记录如下:
黄铜是一种重要的金属,它是铜和锌的合金,可用来制造机器、电器零件及日常用品.为了测定黄铜样品的组成,取五份样品分别加稀硫酸反应,其实验数据记录如下:| 样品 | 第1份 | 第2份 | 第3份 | 第4份 | 第5份 |
| 取样品质量(g) | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 |
| 取稀硫酸质量(g) | 30.0 | 60.0 | 90.0 | 120.0 | 150.0 |
| 产生气体质量(g) | 0.3 | 0.6 | 0.9 | 1.0 | 1.0 |
(1)根据实验数据分析,从第4份开始,金属已经反应完全了.
(2)列式计算该黄铜样品中金属锌的质量分数.(要求写出计算过程)
(3)列式计算稀硫酸的溶质质量分数.(要求写出计算过程)
(4)在给出的坐标纸上,画出40.0g样品中加稀硫酸的质量与产生气体质量的关系曲线.
1. “在学校的元旦联欢会上,某同学表演了‘水能生火’的魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.”
“在学校的元旦联欢会上,某同学表演了‘水能生火’的魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.”
小颖看到这段话后非常感兴趣,她和同学们一起对该问题进行了一系列的探究.
[提出问题]过氧化钠与水反应生成了什么物质?为什么脱脂棉会燃烧?
[猜想]①可能有一种气体和另一种物质生成
②反应过程中可能有能量变化
[设计装置]如图所示
[实验探究]
实验一:探究反应后生成的气体是什么?
(1)打开右图装置中分液漏斗的活塞,控制滴加水的速度,观察到试管内有气泡产生,用带火星的木条靠近P处,木条复燃.说明生成的气体是氧气;
(2)实验中,还观察到伸入烧杯中的导管口有气泡冒出,请解释产生该现象的原因:过氧化钠与水反应放出热量,使瓶中的空气受热膨胀,因此伸入烧杯中的导管口看到有气泡产生.
实验二:探究反应后生成的另一种物质是什么?
(1)小明猜想另一种物质是Na2CO3,小军认为不可能.为了证实小军的看法,请你设计一个证明CO32-不存在的实验:
(2)小军取反应后所得的溶液于试管中,滴入无色酚酞试液,发现试管中的溶液变成红色,说明反应后所得的溶液呈碱性;
[表 达]小军根据实验探究的结果,写出了过氧化钠和水反应的化学方程式为2Na2O2+2H2O═4NaOH+O2↑.
[发现问题]小娟发现在小军的实验中,试管中的溶液变成红色后,一会儿又变成无色.
[深入探究]实验三:探究滴入无色酚酞试液后,变成红色的溶液为什么会褪色?
小娟经查阅资料,设计了如下实验方案,并将有关现象记录在表中.
(1)根据小娟的实验探究,过氧化钠和水反应除了小军写出的反应外还存在另一个反应,其化学方程式为Na2O2+2H2O═2NaOH+H2O2.
(2)综合分析上述实验,猜想使变红的酚酞褪色的物质是H2O2,请你用实验1所得的溶液,设计一个简单实验证明你的猜想在实验1所得溶液中加入少许MnO2,静置到无气体产生时,再加入无色酚酞试液,溶液变红且不再褪色.
(3)根据实验3测得的气体体积说明了水与Na2O2反应生成的H2O2约有$\frac{1}{3}$发生分解.[反思与评价]根据小娟的实验探究方案,请你再提出一个需要探究的问题H2O2使变红的酚酞褪色的原因是什么.
 “在学校的元旦联欢会上,某同学表演了‘水能生火’的魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.”
“在学校的元旦联欢会上,某同学表演了‘水能生火’的魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.”小颖看到这段话后非常感兴趣,她和同学们一起对该问题进行了一系列的探究.
[提出问题]过氧化钠与水反应生成了什么物质?为什么脱脂棉会燃烧?
[猜想]①可能有一种气体和另一种物质生成
②反应过程中可能有能量变化
[设计装置]如图所示
[实验探究]
实验一:探究反应后生成的气体是什么?
(1)打开右图装置中分液漏斗的活塞,控制滴加水的速度,观察到试管内有气泡产生,用带火星的木条靠近P处,木条复燃.说明生成的气体是氧气;
(2)实验中,还观察到伸入烧杯中的导管口有气泡冒出,请解释产生该现象的原因:过氧化钠与水反应放出热量,使瓶中的空气受热膨胀,因此伸入烧杯中的导管口看到有气泡产生.
实验二:探究反应后生成的另一种物质是什么?
(1)小明猜想另一种物质是Na2CO3,小军认为不可能.为了证实小军的看法,请你设计一个证明CO32-不存在的实验:
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量反应后的溶液于试管中,滴入足量的稀盐酸 | 没有气泡产生 | 生成物中没有CO32- |
[表 达]小军根据实验探究的结果,写出了过氧化钠和水反应的化学方程式为2Na2O2+2H2O═4NaOH+O2↑.
[发现问题]小娟发现在小军的实验中,试管中的溶液变成红色后,一会儿又变成无色.
[深入探究]实验三:探究滴入无色酚酞试液后,变成红色的溶液为什么会褪色?
小娟经查阅资料,设计了如下实验方案,并将有关现象记录在表中.
| 实验序号 | 实验方案 | 实验现象 |
| 1 | 将水滴入盛有过氧化钠固体的试管中,配制成溶液,用带火星的木条检验生成的气体 | 反应激烈,有大量气体产生,并能使带火星的复燃 |
| 2 | 取三份实验1所得溶液分装于三支试管中进行如下实验: ①第一份中加入紫色石蕊试液 ②第二份中加入无色酚酞试液 ③第三份中先加水再加入无色酚酞试液 | ①溶液变蓝且长时间不褪色 ②溶液显红色,半分钟内褪色 ③溶液显红色,半分钟内褪色 |
| 3 | ①称取3.9g过氧化钠固体,逐滴加入约50mL水. ②待不再产生气体,10min以后,加入用小纸片包好的MnO2,迅速塞紧双孔塞,轻轻摇动反应器,纸包自动散开,MnO2与溶液开始接触. | ①测得氧气体积为185mL左右 ②又产生大量氧气,至反应完全以后,又测得产生了374mL氧气(两次测定条件均相同) |
(2)综合分析上述实验,猜想使变红的酚酞褪色的物质是H2O2,请你用实验1所得的溶液,设计一个简单实验证明你的猜想在实验1所得溶液中加入少许MnO2,静置到无气体产生时,再加入无色酚酞试液,溶液变红且不再褪色.
(3)根据实验3测得的气体体积说明了水与Na2O2反应生成的H2O2约有$\frac{1}{3}$发生分解.[反思与评价]根据小娟的实验探究方案,请你再提出一个需要探究的问题H2O2使变红的酚酞褪色的原因是什么.


