题目内容
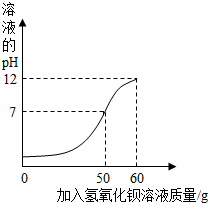 (2013?滨海县二模)为测定某未知浓度的氢氧化钡溶液的溶质质量分数,取某稀硫酸溶液40g,逐滴加入氢氧化钡溶液60g,同时用pH计测定并记录反应过程中混合溶液pH变化情况如图.过滤后得滤液95.34g.已知:Ba(OH)2+H2SO4=Ba SO4↓+2H2O.请计算:
(2013?滨海县二模)为测定某未知浓度的氢氧化钡溶液的溶质质量分数,取某稀硫酸溶液40g,逐滴加入氢氧化钡溶液60g,同时用pH计测定并记录反应过程中混合溶液pH变化情况如图.过滤后得滤液95.34g.已知:Ba(OH)2+H2SO4=Ba SO4↓+2H2O.请计算:(1)生成沉淀Ba SO4的质量;
(2)氢氧化钡溶液的溶质质量分数.
分析:根据图象可知,当加入50g氢氧化钡溶液时,与稀硫酸恰好完全中和,此后所加氢氧化钡溶液不再发生反应,因此,根据质量质量定律可计算加入50g氢氧化钡溶液恰好完全反应时生成沉淀的质量;利用沉淀硫酸钡的质量,根据反应的化学方程式,计算出50g氢氧化钡溶液中溶质氢氧化钡的质量,最后使用溶液中溶质质量分数公式计算氢氧化钡溶液的溶质质量分数.
解答:解:(1)生成的BaSO4质量为:40g+60g-95.34g=4.66 g;
(2)设参加反应的Ba(OH)2的质量为x
Ba(OH)2+H2SO4=BaSO4↓+2H2O
171 233
x 4.66 g
=
x=3.42 g
Ba(OH)2的溶质质量分数=
×100%=6、84%
答:(1)生成沉淀Ba SO4的质量为4.66g;(2)该溶液中Ba(OH)2的溶质质量分数为6.84%.
(2)设参加反应的Ba(OH)2的质量为x
Ba(OH)2+H2SO4=BaSO4↓+2H2O
171 233
x 4.66 g
| 171 |
| x |
| 233 |
| 4.66g |
x=3.42 g
Ba(OH)2的溶质质量分数=
| 3.42g |
| 50g |
答:(1)生成沉淀Ba SO4的质量为4.66g;(2)该溶液中Ba(OH)2的溶质质量分数为6.84%.
点评:本题解题的关键是会根据质量守恒定律求生成沉淀硫酸钡的质量,生成沉淀硫酸钡的质量=稀硫酸的质量+所加入氢氧化钡溶液的质量-过滤后所得滤液的质量.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
 ”和“
”和“ ”表示不同的两种原子,则下列各图示表示化合物的是( )
”表示不同的两种原子,则下列各图示表示化合物的是( )