题目内容
17.下列有关分子、原子、离子的说法不正确的是( )| A. | 分子、原子一定能够保持物质的化学性质 | |
| B. | 分子、原子都在永不停息的做无规则运动 | |
| C. | 原子得失电子形成离子,离子也可以变回原子 | |
| D. | 化学变化中分子一定可分,原子一定不可分 |
分析 构成物质的基本粒子是分子、原子和离子.
微观粒子的质量和体积都很小,微粒之间有一定间隔,总是不断运动的.
解答 解:A、分子、原子不一定能够保持物质的化学性质,例如水中的氢原子和氧原子不能保持水的化学性质,该选项说法不正确;
B、分子、原子都在永不停息的做无规则运动,该选项说法正确;
C、原子得失电子形成离子,离子也可以变回原子,该选项说法正确;
D、化学变化中分子一定可分,原子一定不可分,该选项说法正确.
故选:A.
点评 化学变化中,分子可分,原子不可分,因此原子是化学变化中的最小微粒.

练习册系列答案
相关题目
6.某物质由铁元素和氧元素组成,已知铁元素和氧元素的质量之比是7:3,则该物质的化学式是( )
| A. | FeO | B. | Fe2O 3 | C. | Fe3O4 | D. | FeO3 |
8.探究一、请根据下列实验装置图答问题.
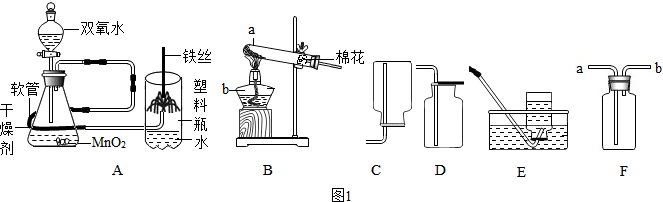
(1)写出图1中仪器a、b、名称:a试管,b酒精灯.
(2)用图1中B装置制取O2的文字(或符号)表达式为高锰酸钾$\stackrel{加热}{→}$锰酸钾+二氧化锰+氧气(2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑),若要收集干燥的氧气应选用的收集装置为D(填装置序号),如果用F装置收集氧气,则应从a端通入,其验满的操作方法是将带火星的木条放在导管口,木条复燃,证明集满.
(3)如图1中A时“铁丝在氧气中燃烧”实验的改进装置,实验时打开分液漏斗活塞,通入干燥氧气约10秒,引燃铁丝下端火柴杆,伸入塑料瓶内,并对准玻璃管扣正上方,观察到的现象是铁丝剧烈燃烧,火星四射,生成黑色固体.
改进后的优点是①②③(填序号).
①氧气无需提前制备和收集,操作更方便
②塑料瓶代替集气瓶,防止集气瓶炸裂,更安全
③装置集氧气的制取、干燥、和性质验证于一体,实验更优化.
(4)某兴趣小组同学将带火星的木条伸入到收集满氧气的集气瓶中,木条复燃,拿出木条,盖好集气瓶,过一会儿,再用带火星的木条伸入瓶中,木条仍然复燃,重复以上操作,直到木条不再复燃,据此现象你能得到的结论是带火星的木条是否复燃与氧气的浓度有关.
(5)该兴趣小组同学还做了如图2中的趣味实验,图中现象是在量筒中涌出柱状的泡沫,可形象地称为“大象牙膏”,其原理主要是双氧水在某些催化剂作用下迅速分解产生水和氧气,反应的文字(或符号)表达式为过氧化氢$\stackrel{二氧化锰}{→}$水+氧气(2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑).
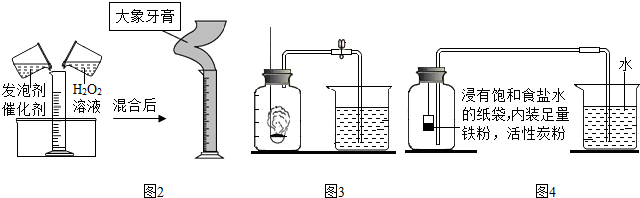
探究二、如图3是小红同学设计的某探究实验的装置,请你协助他共同完成下列实验相关的内容.
(1)实验探究的目的是探究空气中氧气的含量.
(2)收集的信息数据:①空气中N2占78%,O2占21%,其它其它及杂质占1%(按体积计)②O2可支持燃烧③红磷、硫、木炭都可以在空气中燃烧
(3)方案设计:利用A在空气中燃烧以消耗空气中O2的实验完成(填写字母).
A、红磷 B、硫 C、木炭
(4)实验现象:红磷燃烧放出热量,生成大量的白烟,烧杯中的水会进入到瓶中约占瓶中体积的五分之一
(5)实验结论:氧气约占空气体积的五分之一
(6)写出该反应的文字(或符号)表达式是4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5.
(7)结论分析:若实验所得结论与实际结论偏高,可能的原因是:
a、红磷的量不足
b、没有等装置冷却就打开止水夹
(8)启示:通过该实验,我们预测瓶中剩余氮气的一个性质:难溶于水,不支持燃烧.
【实验改进】小刚同学查得实验资料表明:燃烧过程中当氧气体积分数低于7%时,红磷就无法继续燃烧,因此通过上述实验,测置结果与理论值误差较大.
【实验改进】
Ⅰ.根据铁在空气中生锈的二元论设计如图4实验装置,再次测定空气中氧气含量,装置中饱和食盐水、活性炭会加速铁生锈.
Ⅱ.测得实验数据如表
(9)【交流表达】
①铁生锈过程发生复杂的化学反应,首先是铁与氧气、水反应生成氢氧化亚铁[Fe(OH)2],写出该反应的文字表达式为2Fe+2H2O+O2=2Fe(OH)2.
②根据表中数据计算,改进实验后测得的空气中氧气的体积分数是20.2%(计算结果精确到0.1%).
③从实验原理角度分析,改进后的实验结果比前者准确度更高的原因是:(写出一个即可)①铁的缓慢氧化使集气瓶中的氧气消耗更彻底,使实验结果更准确.②测量时考虑到导管容积和扣除内容物后的集气瓶容积,使实验结果更准确.

(1)写出图1中仪器a、b、名称:a试管,b酒精灯.
(2)用图1中B装置制取O2的文字(或符号)表达式为高锰酸钾$\stackrel{加热}{→}$锰酸钾+二氧化锰+氧气(2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑),若要收集干燥的氧气应选用的收集装置为D(填装置序号),如果用F装置收集氧气,则应从a端通入,其验满的操作方法是将带火星的木条放在导管口,木条复燃,证明集满.
(3)如图1中A时“铁丝在氧气中燃烧”实验的改进装置,实验时打开分液漏斗活塞,通入干燥氧气约10秒,引燃铁丝下端火柴杆,伸入塑料瓶内,并对准玻璃管扣正上方,观察到的现象是铁丝剧烈燃烧,火星四射,生成黑色固体.
改进后的优点是①②③(填序号).
①氧气无需提前制备和收集,操作更方便
②塑料瓶代替集气瓶,防止集气瓶炸裂,更安全
③装置集氧气的制取、干燥、和性质验证于一体,实验更优化.
(4)某兴趣小组同学将带火星的木条伸入到收集满氧气的集气瓶中,木条复燃,拿出木条,盖好集气瓶,过一会儿,再用带火星的木条伸入瓶中,木条仍然复燃,重复以上操作,直到木条不再复燃,据此现象你能得到的结论是带火星的木条是否复燃与氧气的浓度有关.
(5)该兴趣小组同学还做了如图2中的趣味实验,图中现象是在量筒中涌出柱状的泡沫,可形象地称为“大象牙膏”,其原理主要是双氧水在某些催化剂作用下迅速分解产生水和氧气,反应的文字(或符号)表达式为过氧化氢$\stackrel{二氧化锰}{→}$水+氧气(2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑).

探究二、如图3是小红同学设计的某探究实验的装置,请你协助他共同完成下列实验相关的内容.
(1)实验探究的目的是探究空气中氧气的含量.
(2)收集的信息数据:①空气中N2占78%,O2占21%,其它其它及杂质占1%(按体积计)②O2可支持燃烧③红磷、硫、木炭都可以在空气中燃烧
(3)方案设计:利用A在空气中燃烧以消耗空气中O2的实验完成(填写字母).
A、红磷 B、硫 C、木炭
(4)实验现象:红磷燃烧放出热量,生成大量的白烟,烧杯中的水会进入到瓶中约占瓶中体积的五分之一
(5)实验结论:氧气约占空气体积的五分之一
(6)写出该反应的文字(或符号)表达式是4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5.
(7)结论分析:若实验所得结论与实际结论偏高,可能的原因是:
a、红磷的量不足
b、没有等装置冷却就打开止水夹
(8)启示:通过该实验,我们预测瓶中剩余氮气的一个性质:难溶于水,不支持燃烧.
【实验改进】小刚同学查得实验资料表明:燃烧过程中当氧气体积分数低于7%时,红磷就无法继续燃烧,因此通过上述实验,测置结果与理论值误差较大.
【实验改进】
Ⅰ.根据铁在空气中生锈的二元论设计如图4实验装置,再次测定空气中氧气含量,装置中饱和食盐水、活性炭会加速铁生锈.
Ⅱ.测得实验数据如表
| 测量项目 | 实验前 | 实验后 | |
| 烧杯中水的体积 | 烧杯中剩余水的体积 | 集气瓶(扣除内容物)和导管的容积 | |
| 体积 | 80.0 | 54.5 | 126.0 |
①铁生锈过程发生复杂的化学反应,首先是铁与氧气、水反应生成氢氧化亚铁[Fe(OH)2],写出该反应的文字表达式为2Fe+2H2O+O2=2Fe(OH)2.
②根据表中数据计算,改进实验后测得的空气中氧气的体积分数是20.2%(计算结果精确到0.1%).
③从实验原理角度分析,改进后的实验结果比前者准确度更高的原因是:(写出一个即可)①铁的缓慢氧化使集气瓶中的氧气消耗更彻底,使实验结果更准确.②测量时考虑到导管容积和扣除内容物后的集气瓶容积,使实验结果更准确.
5.前者属于物理变化,后者属于化学变化的是( )
| A. | 水结成冰,冰融化成水 | B. | 鸡蛋变臭,动、植物呼吸 | ||
| C. | 酒精挥发,酒精燃烧 | D. | 铁生锈,电灯通电发光 |

 某中学化学兴趣小组按照图甲的实验方法,做木炭与氧化铜反应实验时,发现很难观察到紫红色铜的生成,却往往有暗红色固体出现.
某中学化学兴趣小组按照图甲的实验方法,做木炭与氧化铜反应实验时,发现很难观察到紫红色铜的生成,却往往有暗红色固体出现. 图是钠元素的元素周期,该元素的原子序数是11,核外电子数是11,根据该元素的原子序数,写出原子序数为14的元素的元素符号Si.
图是钠元素的元素周期,该元素的原子序数是11,核外电子数是11,根据该元素的原子序数,写出原子序数为14的元素的元素符号Si.