题目内容
20.最近,科学家研制出一种纸质电池,这种“软电池”采用薄层纸片作为载体和传导体,在一边附着锌,在另一边附着二氧化锰.电池总反应为:Zn+2MnO2+X═ZnO+2MnOOH.下列说法不正确的是( )| A. | X为H2O | |
| B. | 该反应中MnO2为催化剂 | |
| C. | 该反应中共有3种氧化物 | |
| D. | 反应前后锌元素的化合价发生了变化 |
分析 A、根据化学反应方程式Zn+2MnO2+X═ZnO+2MnOOH.利用质量守恒定律中的守恒法来解答X的化学式;
B、根据反应过程来分析;
C、根据氧化物的概念分析;
D、单质的化合价为0.
解答 解:A、由化学反应方程式为Zn+2MnO2+X═ZnO+2MnOOH.Zn、Mn元素的原子的个数反应前后相等,
根据质量守恒定律可知,H、O元素的原子个数前后也应相等,
反应后共有2个H原子,5个O原子,而反应前共有4个O原子,
则X中共有2个H原子,1个O原子,
则X的化学式为H2O,
B、催化剂能改变化学反应的速率,而本身的质量和化学性质不变.而在该反应中二氧化锰是反应物,质量减少,故错误;
C、氧化物是由两种元素组成,其中一种是氧元素的化合物,MnO2、H2O、ZnO是氧化物,故正确;
D、反应前后锌元素以单质的形式存在,化合价为0,反应后锌元素以化合物的形式存在,化合价不为0,故正确;
故选B.
点评 本题属于信息给予题,解题的关键是认真阅读题干,提取有用的信息,分析、判断有关的问题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.某班同学用氧化钠溶液和稀盐酸进行中和反应实验:

(1)甲同学实验操作如图:在烧杯中加入约5ml氢氧化钠溶液,滴入几滴无色酚酞溶液,此时溶液呈红色.
接着用滴管滴入一定量的稀盐酸,再用玻璃棒搅拌,发现溶液为无色,于是甲同学得出两者恰好中和的结论,反应的化学方程式为NaOH+HCl=NaCl+H2O.
(2)乙同学对甲同学的结论提出了质疑,并对反应后溶液中溶质成分进行探究.
【实验探究】
反应后溶液中的溶质是什么?
猜想一:只有NaCl
猜想二:NaCl和HCl
猜想三:NaCl和NaOH
以上猜想中,你觉得不合理的是猜想三.
为了验证另外两种猜想,乙同学设计如下实验方案:
【反思交流】
实验结束后,废液处理方法正确的是B(填序号).
A、倒入下水道 B、倒入废液缸 C、带出实验室.

(1)甲同学实验操作如图:在烧杯中加入约5ml氢氧化钠溶液,滴入几滴无色酚酞溶液,此时溶液呈红色.
接着用滴管滴入一定量的稀盐酸,再用玻璃棒搅拌,发现溶液为无色,于是甲同学得出两者恰好中和的结论,反应的化学方程式为NaOH+HCl=NaCl+H2O.
(2)乙同学对甲同学的结论提出了质疑,并对反应后溶液中溶质成分进行探究.
【实验探究】
反应后溶液中的溶质是什么?
猜想一:只有NaCl
猜想二:NaCl和HCl
猜想三:NaCl和NaOH
以上猜想中,你觉得不合理的是猜想三.
为了验证另外两种猜想,乙同学设计如下实验方案:
| 实验操作 | 实验现象 | 实验结论 |
| 取少量反应后的溶液于试管中滴入Na2CO3溶液 | 有气泡产生 | 猜想二成立 |
实验结束后,废液处理方法正确的是B(填序号).
A、倒入下水道 B、倒入废液缸 C、带出实验室.
15.下列依据实验目的所设计的实验操作中,正确的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 检验某气体是否为CO2 | 将燃着的木条伸入气体中 |
| B | 鉴别NaCl溶液和稀盐酸 | 滴加无色酚酞溶液 |
| C | 除去CaCO3中的Na2CO3 | 加水溶解,过滤 |
| D | 除去CO2中的CO | 点燃 |
| A. | A | B. | B | C. | C | D. | D |
5.“五水共治”是今年政府治理环境的一大实事.pH是水质监测的重要指标之一,下列采集到的水样中酸性最强的是( )
| A. | 工厂排放的废水:pH=4.3 | B. | 温瑞塘河水:pH=6.5 | ||
| C. | 瓯江水:pH=7.0 | D. | 楠溪江江水:pH=7.3 |
9. 同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应.
同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应.
(1)【实验准备】
①查阅资料:NaHCO3+NaOH═Na2CO3+H2O
Ca(OH)2+NaCO3═CaCO3↓+2NaOH
CaCl2+2NaOH═Ca(OH)2↓(微溶)+2NaCl
2NaHCO3(溶液)$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑
NaHCO3+HCl═NaHCl+H2O+CO2↑
Ca(OH)2+NaHCO3═CaCO3↓+NaOH+H2O
②前期实验
用一定溶质的质量分数的NaHCO3、NaOH和Na2CO3三种溶液进行如表实验,为设计实验方案提供参考.
Ⅰ对应反应的化学方程式为HCl+NaOH═NaCl+H2O.Ⅱ的现象为有沉淀产生.
实验过程
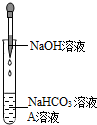
【实验1】证明NaOH溶液与NaHCO3溶液反应生成了Na2CO3
同学们选用如表实验中的药品,设计了如图所示实验,先在NaHCO3溶液中加入A溶液,无明显现象,再滴加NaOH溶液,溶液变浑浊,则A溶液是CaCl2.有同学提出这个实验不足以证明有Na2CO3生成,其理由是CaCl2 和NaOH反应生成Ca(OH)2,氢氧化钙是微溶物,在溶液中也产生沉淀.为了证明有Na2CO3生成,需要继续进行的操作是:取少量反应后的滤渣加入足量的取少量反应后滤渣加入足量的稀盐酸,若产生无色气体证明有Na2CO3生成,反之则没有.若产生无色气体证明有Na2CO3生成,反之则没有.
【实验2】证明NaOH溶液与NaHCO3溶液反应后NaHCO3不存在
同学们参考表中的实验,又设计了一个实验,虽然没有观察到明显的实验现象,但可以证明反应发生了,该实验方案是取少量反应后的溶液进行取少量反应后的溶液加热至沸腾(填操作),将产生的气体通入澄清石灰水,若澄清石灰水变浑浊,证明有NaHCO3存在,反之则没有.
 同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应.
同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应.(1)【实验准备】
①查阅资料:NaHCO3+NaOH═Na2CO3+H2O
Ca(OH)2+NaCO3═CaCO3↓+2NaOH
CaCl2+2NaOH═Ca(OH)2↓(微溶)+2NaCl
2NaHCO3(溶液)$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑
NaHCO3+HCl═NaHCl+H2O+CO2↑
Ca(OH)2+NaHCO3═CaCO3↓+NaOH+H2O
②前期实验
用一定溶质的质量分数的NaHCO3、NaOH和Na2CO3三种溶液进行如表实验,为设计实验方案提供参考.
| NaHCO3溶液 | NaOH溶液 | Na2CO3溶液 | |
| 加入稀盐酸 | 产生气泡 | Ⅰ | 产生气泡 |
| 加入澄清石灰水 | 溶液变浑浊 | 无明显变化 | Ⅱ |
| 加入CaCl2溶液 | 无明显变化 | 溶液变浑浊 | 溶液变浑浊 |
| 加热溶液至沸腾,将 气体通入澄清石灰水 | 澄清石灰水 变浑浊 | 澄清石灰水 无明显变化 | 澄清石灰水 无明显变化 |
实验过程
【实验1】证明NaOH溶液与NaHCO3溶液反应生成了Na2CO3
同学们选用如表实验中的药品,设计了如图所示实验,先在NaHCO3溶液中加入A溶液,无明显现象,再滴加NaOH溶液,溶液变浑浊,则A溶液是CaCl2.有同学提出这个实验不足以证明有Na2CO3生成,其理由是CaCl2 和NaOH反应生成Ca(OH)2,氢氧化钙是微溶物,在溶液中也产生沉淀.为了证明有Na2CO3生成,需要继续进行的操作是:取少量反应后的滤渣加入足量的取少量反应后滤渣加入足量的稀盐酸,若产生无色气体证明有Na2CO3生成,反之则没有.若产生无色气体证明有Na2CO3生成,反之则没有.
【实验2】证明NaOH溶液与NaHCO3溶液反应后NaHCO3不存在
同学们参考表中的实验,又设计了一个实验,虽然没有观察到明显的实验现象,但可以证明反应发生了,该实验方案是取少量反应后的溶液进行取少量反应后的溶液加热至沸腾(填操作),将产生的气体通入澄清石灰水,若澄清石灰水变浑浊,证明有NaHCO3存在,反之则没有.