题目内容
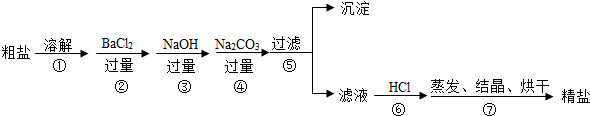
6.现有一包氯化钾粉末,可能含有氯化钙、氯化镁、氯化铁、氯化钠等杂质.【提出问题】如何才能验证氯化钾中所含杂质的成分,并得到纯度较高的氯化钾?
【查阅资料】
(1)碳酸钾的水溶液显碱性;
(2)氢氧化钙是微溶物,水中出现过多氢氧化钙就会出现浑浊甚至于沉淀.
【实验方案】某同学为了验证氯化钾中所含杂质的成分,设计了如下实验方案并进行实验.
①取样品20g放入盛有水的烧杯中,得到无色澄清溶液;
②向①所得溶液中滴加稍过量的氢氧化钾溶液,出现白色浑浊,静止片刻后过滤;
③向②所得的滤液中加入稍过量的碳酸钾溶液,出现白色沉淀,静止片刻后过滤;
④将③所得滤液滴加稍过量的稀盐酸,蒸发结晶.
【交流表达】
(1)由实验①可知,该粉末中一定不含氯化铁;
(2)由实验②可知,该粉末中一定含有氯化镁,另外,实验②要用到的玻璃仪器有烧杯、玻璃棒、滴管和漏斗;
(3)由实验③可知,该粉末中一定含有氯化钙;该步骤发生反应的化学方程式为CaCl2+K2CO3═CaCO3↓+2KCl;
(4)若向实验③所得滤液中滴加无色酚酞溶液,溶液变成红色,是否可以说明碳酸钾溶液滴加已经过量,请说明你的理由碳酸钾溶液显碱性;
【含量计算】
(5)实验步骤③中,经过滤、烘干,得到固体4g,通过计算求原样品中氯化钙的含多少g?(要求写出计算过程)
【反思评价】
(6)有同学认为氢氧化钾溶液和碳酸钾溶液可以改为氢氧化钠溶液和碳酸钠溶液,你认为这种方法不可行(选填“可行”或“不可行”);
(7)有同学认为由实验②不能说明一定含有氯化镁,他的理由氯化钙与氢氧化钾反应产生的氢氧化钙微溶于水.
分析 【交流表达】(1-4)根据实验现象和氯化钙、氯化镁、氯化铁、氯化钠性质进行分析解答;
(5)根据固体的成分是碳酸钙,可求出原样品中氯化钙的质量;
(6)该问题是探究氯化钾中所含杂质的成分,并得到纯度较高的氯化钾,根据提纯原则解释;
(7)根据生成物质的溶解性作出判断.
解答 解:(1)由实验①得到无色澄清溶液,可知该粉末中一定不含氯化铁,因为氯化铁溶液为黄色;
(2)该粉末中一定含有氯化镁,则加入过量的氢氧化钾溶液,出现白色浑浊,需要过滤,所以实验②要用到的玻璃仪器有烧杯、玻璃棒、滴管和漏斗;
(3)由实验③滤液中加入稍过量的碳酸钾溶液,出现白色沉淀可知该粉末中一定含有氯化钙;因为 CaCl2+Na2CO3═CaCO3↓+2NaCl;
(4)若向实验③所得滤液中滴加无色酚酞溶液,溶液变成红色,说明了碳酸钾溶液滴加已经过量,因为碳酸钾溶液显碱性;
(5)设原样品中氯化钙的质量为x
CaCl2+K2CO3═CaCO3↓+2KCl
111 100
x 4g
$\frac{111}{x}=\frac{100}{4g}$
解得x=4.44g
所以求原样品中氯化钙4.44g.
(6)该问题是探究氯化钾中所含杂质的成分,并得到纯度较高的氯化钾,如果氢氧化钾溶液和碳酸钾溶液可以改为氢氧化钠溶液和碳酸钠溶液会混入新杂质钠离子,故不可行;
(7)有同学认为由实验②不能说明一定含有氯化镁,原因是氯化钙与氢氧化钾反应产生的氢氧化钙微溶于水.
故答案为:(1)氯化铁;(2)漏斗
(3)氯化钙 CaCl2+K2CO3═CaCO3↓+2KCl;
(4)碳酸钾溶液显碱性
(5)4.44g;
(6)不可行;
(7)氯化钙与氢氧化钾反应产生的氢氧化钙微溶于水
点评 本题属于分离混合物及除杂问题的考查,采用的是化学转化法,在做物质的除杂题时,要搞清除需要除去的离子,在选择适当的试剂将其沉淀,当加入的试剂的状态和杂质状态相同时,要注意加入量的控制.

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案| A. | PM2.5与雾霾天气 | B. | 煤气中毒 | ||
| C. | 形成酸雨的罪魁祸首 | D. | 新装修房屋内空气中的杀手 |
| A. | 生石灰可用来干燥过氧化氢溶液(又称双氧水)制得的氧气 | |
| B. | 打开浓盐酸的瓶盖,见到瓶口出现白雾现象 | |
| C. | 氢氧化钠不能用来治疗胃酸过多症 | |
| D. | 紫色石蕊遇到稀酸变为红色 |
| A. | 硝酸钾 | B. | 氯化钠 | C. | 高锰酸钾 | D. | 碳酸钙 |
| A. |  向一定量稀盐 向一定量稀盐酸中加水稀释 | |
| B. |  向硫酸和硫酸铜的混合稀溶液中,逐滴加入氢氧化钠溶液 向硫酸和硫酸铜的混合稀溶液中,逐滴加入氢氧化钠溶液 | |
| C. |  足量的镁片和铁片分别与等质量、等质量分数稀盐酸反应 足量的镁片和铁片分别与等质量、等质量分数稀盐酸反应 | |
| D. |  加热一定量的 加热一定量的高锰酸钾固体 |
| A. | 汽油挥发 | B. | 海水晒盐 | C. | 石蜡融化 | D. | 铁生锈 |
 作图法是对实验数据处理和分析的一种常用方法.甲、乙两种固体物质的溶解度曲线如图所示,根据图示回答下列问题:
作图法是对实验数据处理和分析的一种常用方法.甲、乙两种固体物质的溶解度曲线如图所示,根据图示回答下列问题: 如图是甲、乙、丙三种固体物质在水中的溶解度曲线.
如图是甲、乙、丙三种固体物质在水中的溶解度曲线.