题目内容
19.氯化亚铜(CuCl)广泛应用于冶金、电镀、医药等行业.已知CuCl难溶于水和乙醇,在潮湿空气中易变质.CuCl的制备流程如下:
(1)“滤液1”中除了Na+、SO42-外,还存在较多的离子是Cu2+、Cl-(写离子符号)
(2)“反应”中发生的化学变化是2CuCl2+Na2SO3=2CuCl↓+2NaCl+SO3,产生的SO3迅速与水化合生成一种酸,该反应的化学方程式为SO3+H2O═H2SO4.
(3)“操作a”的名称是过滤.本流程中可以循环利用的物质(水除外)是NaCl.(写化学式)
(4)可用“水洗”的原因是能够除去可溶性杂质,“醇洗”的目的是可以除去水,防止在后续步骤中CuCl变质.
(5)160g CuSO4与足量NaCl经上述制备流程,可生成的CuCl最多是99.5g.
分析 (1)“滤液1”中主要物质是硫酸钠和氯化铜;
(2)三氧化硫和水反应生成硫酸;
(3)通过过滤能够把液体和固体分离;
根据工艺流程可以判断循环利用的物质;
(4)可用“水洗”的原因是能够除去可溶性杂质,“醇洗”的目的是可以除去水,防止在后续步骤中CuCl变质;
(5)由工艺流程可知,硫酸铜的铜元素完全转化到了氯化亚铜中.
解答 解:(1)“滤液1”中除了Na+、SO42-外,还存在较多的离子是 Cu2+、Cl-.
故填:Cu2+;Cl-.
(2)产生的SO3迅速与水化合生成硫酸,该反应的化学方程式为:SO3+H2O═H2SO4.
故填:SO3+H2O═H2SO4.
(3)“操作a”的名称是过滤,通过过滤把液体和固体分离;
本流程中可以循环利用的物质(水除外)是NaCl.
故填:过滤;NaCl.
(4)可用“水洗”的原因是能够除去可溶性杂质,“醇洗”的目的是可以除去水,防止在后续步骤中CuCl变质.
故填:能够除去可溶性杂质;可以除去水,防止在后续步骤中CuCl变质.
(5)160gCuSO4中铜元素质量为:160g×$\frac{64}{160}$×100%=64g,因为硫酸铜的铜元素完全转化到了氯化亚铜中,因此足量NaCl经上述制备流程,可生成的CuCl最多是:64g÷($\frac{64}{99.5}$×100%)=99.5g,
故填:99.5.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.汽车自燃时,下列措施正确的是( )
| A. | 加速行驶,让风把火吹灭 | |
| B. | 打开车窗和引擎盖使空气流通进行散热 | |
| C. | 小火时,用灭火器对准火源喷灭火剂 | |
| D. | 打开汽车空调,使温度降低至着火点以下 |
7.“端午佳节,粽叶飘香”,我们过节有吃盐蛋、粽子、糖包、肉包的习俗,从均衡营养的角度分析,还需要补充的主要营养素是( )
| A. | 蛋白质 | B. | 糖类 | C. | 维生素 | D. | 油脂 |
9.根据如图的溶解度曲线,判断下列叙述正确的是( )
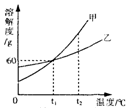

| A. | 甲的溶解度大于乙的溶解度 | |
| B. | 向l00g水中加入60g甲充分搅拌后能形成饱和溶液 | |
| C. | 甲中混有少量乙时,可以用蒸发溶液的方法获得较纯净的乙 | |
| D. | t2℃甲的饱和溶液降低温度后溶解度减小,溶质的质量分数也减小 |
 在学习了金属的化学性质后,科学老师布置了一项课外学习任务:调查化工颜料店出售的涂料添加剂“银粉”是什么金属?某学习小组通过调查,分别获得了“银粉”是银粉、铝粉、锌粉这三种不同结果.为了确定究竟是哪一种金属,学习小组同学将一小包“银粉”带回实验室,进行了如下实验和分析.(相关反应的化学方程式为:Zn+2HCl═ZnCl2+H2↑;2Al+6HCl═2AlCl3+3H2↑)
在学习了金属的化学性质后,科学老师布置了一项课外学习任务:调查化工颜料店出售的涂料添加剂“银粉”是什么金属?某学习小组通过调查,分别获得了“银粉”是银粉、铝粉、锌粉这三种不同结果.为了确定究竟是哪一种金属,学习小组同学将一小包“银粉”带回实验室,进行了如下实验和分析.(相关反应的化学方程式为:Zn+2HCl═ZnCl2+H2↑;2Al+6HCl═2AlCl3+3H2↑)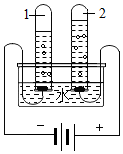 利用如图装置我们认识了水的组成:
利用如图装置我们认识了水的组成:


