题目内容
14.化学实验室要从X、银、铜、锌四种金属混合物中分离某贵重金属.流程如下:
请回答:
(1)四种金属的活动性顺序由强到弱的是Zn、X、Cu、Ag;
(2)固体丙中一定含有的金属是Ag;
(3)写出③中反应的化学方程式Cu+2AgNO3=Cu(NO3)2+2Ag;
(4)固体甲中含有的成分Cu、Ag.
分析 根据金属能与酸反应的排在氢前面,不能与酸反应的排在氢的后面,活泼的金属能把不活泼的金属从盐溶液中置换出来分析金属活动性的顺序及反应过程中发生的反应并分析溶液中的成分.
解答 解:根据金属的活泼性顺序:锌>氢>铜>银,所以向锌、X、铜、银的金属混合物中加入稀硫酸,锌一定参加反应产生气泡,而铜和银一定没反应,得到的滤液A再加入过量的锌得到混合物乙和滤液B,说明锌除了和过量的硫酸反应产生气体外,还和盐溶液发生了置换反应,因此说明锌的活动性比X强,且X位于氢前;由于硫酸过量,固体甲含有铜和银,铜和硝酸银反应产生硝酸铜和银,所以
(1)四种金属的活动性顺序由强到弱的是:Zn>X>Cu>Ag;
(2)固体丙中一定含有的金属是被置换出的银及原有的银;
(3)反应③是铜和硝酸银反应产生硝酸铜和银,化学方程式为;Cu+2AgNO3=Cu(NO3)2+2Ag;
(4)固体甲中含有的成分是Cu、Ag.
故答案为:(1)Zn、X、Cu、Ag;
(2)Ag;
(3)Cu+2AgNO3=Cu(NO3)2+2Ag;
(4)Cu、Ag.
点评 此题以实验设计流程的形式让学生去利用金属活动性顺序表解决有关金属化学性质的问题,有一定的难度,解题的关键是熟练运用金属活动性的顺序意义.

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
7.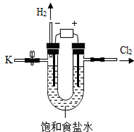 某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实
某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实
验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下探究.
老师提示:I.电解饱和食盐水的化学方程式:
2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑
II.忽略其他可能发生的反应对以下实验的影响.
探究活动一:检验待测液中含有氢氧化钠
(1)同学们选用某种酸碱指示剂对待测液进行检验,请你将实验报告填写完整.
探究活动二:测定待测液中氢氧化钠的质量分数
【实验1】用酸碱中和法测定
甲组同学称取一定质量的待测液于烧杯中,加水稀释,用带有刻度的滴管逐滴加入一定溶质质量分数的稀盐酸,边加边振荡,用pH计测定溶液的pH,数据如下:
(2)利用氢氧化钠与稀盐酸恰好完全反应时的实验数据,计算所称取待测液中氢氧化钠的质量,应从选用稀盐酸的体积为9.8mL.
【实验2】用沉淀法测定
资料摘要:氢氧化钠与氯化镁溶液中发生反应:
2NaOH+MgCl2=Mg(OH)2↓+2NaCl
乙组同学按如图所示的实验步骤进行实验:
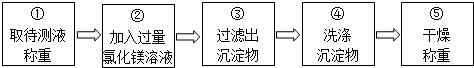
(3)步骤②加入的氯化镁溶液必需足量或过量,其目的是使氢氧化钠完全反应.滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否过量的具体操作:静置,取上层清液与试管中,滴加氢氧化钠溶液,产生白色沉淀,说明氯化镁溶液已经过量(写出实验步骤、现象和结论).
(4)步骤③过滤出的沉淀物是氢氧化镁.
(5)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,所测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).
 某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实
某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下探究.
老师提示:I.电解饱和食盐水的化学方程式:
2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑
II.忽略其他可能发生的反应对以下实验的影响.
探究活动一:检验待测液中含有氢氧化钠
(1)同学们选用某种酸碱指示剂对待测液进行检验,请你将实验报告填写完整.
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量待测液于试管中,滴加几滴无色酚酞试液 | 酚酞试液变红色 | 待测液呈碱性,表明含有氢氧化钠 |
【实验1】用酸碱中和法测定
甲组同学称取一定质量的待测液于烧杯中,加水稀释,用带有刻度的滴管逐滴加入一定溶质质量分数的稀盐酸,边加边振荡,用pH计测定溶液的pH,数据如下:
| 加入稀盐酸的体积/mL | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 9.8 |
| 烧杯中溶液的pH | 13.0 | 12.9 | 12.8 | 12.6 | 12.3 | 7.0 |
【实验2】用沉淀法测定
资料摘要:氢氧化钠与氯化镁溶液中发生反应:
2NaOH+MgCl2=Mg(OH)2↓+2NaCl
乙组同学按如图所示的实验步骤进行实验:

(3)步骤②加入的氯化镁溶液必需足量或过量,其目的是使氢氧化钠完全反应.滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否过量的具体操作:静置,取上层清液与试管中,滴加氢氧化钠溶液,产生白色沉淀,说明氯化镁溶液已经过量(写出实验步骤、现象和结论).
(4)步骤③过滤出的沉淀物是氢氧化镁.
(5)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,所测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).
19.我国新《环境保护法》自2015年1月1日起实施,保护环境,人人有责.下列做法不合理的是( )
| A. | 开发新能源,禁止开采和使用化石燃料 | |
| B. | 在生产和生活中提倡使用节能技术和节能用具 | |
| C. | 提倡乘坐公交车,骑自行车或步行的出行方式 | |
| D. | 植树造林,严禁乱砍滥伐 |
