题目内容
18.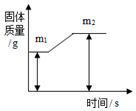 质量守恒定律是一条重要规律,请利用该规律的相关知识回答下列问题.
质量守恒定律是一条重要规律,请利用该规律的相关知识回答下列问题.(1)化学反应前后肯定发生变化的是C(填写序号).
A.分子数目 B.元素种类 C.物质种类 D.物质的总质量
(2)铁丝在氧气中燃烧(只考虑氧气参加反应),若反应前后固体质量变化用如图表示,则m1与m2之差表示参加反应的氧气的质量.
分析 (1)化学反应前后,元素的种类不变,原子的种类、总个数不变;
(2)铁和氧气反应生成四氧化三铁.
解答 解:(1)反应前后原子数目不变,元素种类不变,原子种类不变,物质的总质量不变;
反应前后分子数目可能改变,也可能不变,物质种类一定改变.
故选C.
(2)铁丝在氧气中燃烧生成四氧化三铁,则m2与m1之差表示参加反应的氧气的质量.
故填:参加反应的氧气.
点评 化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、进行相关方面计算的基础.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
8.从下列实验现象中,得到的结论正确的是( )
| A. | 往溶液中加BaCl2溶液生成不溶于硝酸的白色沉淀,说明溶液中一定含SO42- | |
| B. | 浓硫酸能使纸张碳化变黑,说明浓硫酸具有吸水性 | |
| C. | 氯化钠晶体不导电,说明氯化钠晶体中不存在自由移动的离子 | |
| D. | 溶液中加稀盐酸,有能使澄清石灰水变浑浊的气体放出,说明溶液中有CO32- |
7.已知30℃时,Na2SO3在水中的溶解度为36g,在一定量Na2SO3的溶液中加入6.4g Na2SO3后,恰好为30℃的饱和溶液.若用Na2SO3•7H2O晶体代替Na2SO3,欲使原溶液在30℃时恰好饱和溶液,则需要加入的Na2SO3•7H2O的质量为( )
| A. | 12.8g | B. | 14.6g | C. | 20g | D. | 25g |
8. 水中重要的物质,在实验室中常用于溶解物质、配制溶液.向50mL水(密度为1g•mL-1)中溶解一定量硝酸钾固体的操作如下,请根据如图实验现象溶解度表回答
水中重要的物质,在实验室中常用于溶解物质、配制溶液.向50mL水(密度为1g•mL-1)中溶解一定量硝酸钾固体的操作如下,请根据如图实验现象溶解度表回答
硝酸钾溶解度
(1)A、B、C中一定是饱和溶液的是B,一定是不饱和溶液的是A;(填字母)
(2)当x=5.8g时,B中恰好没有固体剩余.
 水中重要的物质,在实验室中常用于溶解物质、配制溶液.向50mL水(密度为1g•mL-1)中溶解一定量硝酸钾固体的操作如下,请根据如图实验现象溶解度表回答
水中重要的物质,在实验室中常用于溶解物质、配制溶液.向50mL水(密度为1g•mL-1)中溶解一定量硝酸钾固体的操作如下,请根据如图实验现象溶解度表回答硝酸钾溶解度
| 温度℃ | 0 | 10 | 20 | T2 | 40 | 50 |
| 溶解度g | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 |
(2)当x=5.8g时,B中恰好没有固体剩余.


 如图是小柯同学在复习科学时,构建酸通性的“手掌图”.
如图是小柯同学在复习科学时,构建酸通性的“手掌图”.