题目内容
13.实验测得某些食物的近似pH如下,下列说法正确的是( )| 食物 | 泡菜 | 葡萄 | 番茄 | 苹果 | 牛奶 | 玉米粥 |
| pH | 3.4 | 4.2 | 4.4 | 3.1 | 6.5 | 7.8 |
| A. | 胃酸过多的人应少食泡菜 | B. | 用湿润的pH试纸蘸取葡萄汁测其pH | ||
| C. | 番茄的酸性比苹果强 | D. | 牛奶和玉米粥均属于碱性食物 |
分析 A、胃酸内含有盐酸显强酸性,胃酸过多的病人要少食用酸性食品;
B、测定溶液的pH值用玻璃棒蘸取待测液滴在干燥的pH试纸上;
C、当溶液的pH小于7时,呈酸性,且随着pH的减小酸性增强;
D、当溶液的pH大于7时,呈碱性;
解答 解:A、泡菜的pH小于7,显酸性,所以胃酸过多的人应少食泡菜.故正确;
B、应该用干燥的pH试纸,并且是把葡萄汁滴在pH试纸上测其pH.故错误;
C、番茄的pH大于苹果的pH,所以番茄的酸性比苹果弱.故错误;
D、牛奶的pH小于7,显酸性;玉米粥的pH大于7,显碱性.故错误;
故选A.
点评 掌握溶液的pH与溶液酸碱性之间的关系,并能应用知识分析和解决实际问题,才能对相关方面的问题进行正确的判断.

练习册系列答案
相关题目
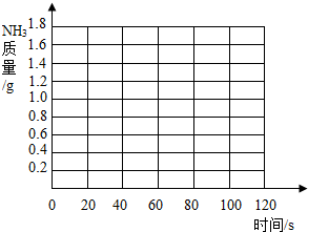
8.化肥对提高农作物的产量具有重要的作用,碳铵(碳酸氢铵)就是农民朋友经常使用的一种氮肥,碳铵易溶于水、受潮时常温分解,温度越高分解越快,遇碱时放出氨气.某校化学兴趣小组为测定某碳铵肥料样品的纯度,将8.5g样品加入足量的浓氢氧化钠溶液中共热,(碳铵中的杂质不与氢氧化钠反应,反应的方程式为NH4HCO3+2NaOH=Na2CO3+2H2O+NH3↑),把产生的所有NH3用足量的硫酸溶液吸收,同时测量两分钟内硫酸溶液增加的质量,结果如下表所示.
试回答下列问题:
(1)根据碳酸氢铵的性质,你认为在使用碳铵肥料时应注意的问题是不能和碱性肥料混用
(2)请在如图所示的坐标纸上,以反应时间为横坐标,以产生NH3质量为纵坐标,画出产生气体的质量随时间变化的关系曲线,并判断表中m约为1.0.
(3)试计算该样品中碳酸氢铵的质量分数(写出计算过程,计算结果保留一位小数)
| 时间/S | 0 | 20 | 30 | 40 | 60 | 80 | 100 | 120 |
| 增加质量/g | 0 | 0.7 | m | 1.2 | 1.5 | 1.6 | 1.7 | 1.7 |
(1)根据碳酸氢铵的性质,你认为在使用碳铵肥料时应注意的问题是不能和碱性肥料混用
(2)请在如图所示的坐标纸上,以反应时间为横坐标,以产生NH3质量为纵坐标,画出产生气体的质量随时间变化的关系曲线,并判断表中m约为1.0.

(3)试计算该样品中碳酸氢铵的质量分数(写出计算过程,计算结果保留一位小数)
18.在学习中要不断总结,归纳发现规律,就能不断提高自己的能力.在标准状况下各气体相对分子质量、密度和实验室收集方法如下表,通过比较找出规律:
(1)从“相对分子质量”和“标况下密度”两列,可归纳出:一般来说,气体相对分子质量越大,标准状况下的密度越大;
(2)密度大于空气的气体可采用向上排空气法收集.
(3)实验室制取的氨气(化学式为NH3),可推测知密度比空气小,可用向下排空气法收集(氨气极易溶于水).
| 气体 | 相对分子质量 | 标况下密度(g/L) | 收集方法 |
| 空气 | 29 | 1.293 | 排水集气法 |
| 氧气 | 32 | 1.429 | 向上排空气法 |
| 二氧化碳 | 44 | 1.964 | 向上排空气法 |
| 氢气 | 2 | 0.089 | 向下排空气法 |
(2)密度大于空气的气体可采用向上排空气法收集.
(3)实验室制取的氨气(化学式为NH3),可推测知密度比空气小,可用向下排空气法收集(氨气极易溶于水).
2.下列选项中属于模型的是( )
| A. |  | B. |  | C. | S=VT | D. |  |
3.某兴趣小组对4瓶无色溶液Na2CO3溶液、NaOH溶液、Ca(OH)2溶液、稀盐酸进行鉴别.
(1)甲组同学利用紫色石蕊试液进行鉴别.
乙组同学不用其他试剂进行鉴别.
乙组同学经过交流后发现,根据小红与小敏的实验现象,小红的结论是错误的.如果小刚所滴加的是NaOH溶液,则他的实验现象是三支试管都无现象.
(1)甲组同学利用紫色石蕊试液进行鉴别.
| 实验步骤 | 现象与结论 |
| ①用4支试管,分别取少量的不同溶液,各滴加紫色石蕊试液. | 1支试管中出现红色,则原溶液是稀盐酸. |
| ②另用3支试管,分别取少量未确定的溶液,各滴加步骤①检验出的溶液. | 1支试管中有气泡产生.则原溶液是Na2CO3溶液. |
| ③另用2支试管,分别取少量未确定的溶液,分别滴加碳酸钠溶液. | 1支试管中有白色沉淀析出,则原溶液是Ca(OH)2溶液. 1支试管中无现象,则原溶液是NaOH溶液. |
| 同学 | 实验操作 | 现 象 | 结 论 |
| 小敏 | 用3支试管,分别取少量不同的溶液,各滴加剩余的另一种溶液. | 1支试管中有气泡产生,其余2支试管中无现象. | 所滴加的溶液是稀盐酸. |
| 小红 | 1支试管中有白色沉淀析出,其余2支试管中无现象. | 所滴加的溶液是Na2CO3溶液. | |
| 小刚 | … | … |