题目内容
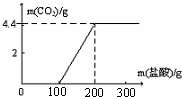 (2009?海淀区二模)某小组称取18.6g变质的氢氧化钠样品(杂质为碳酸钠),配成溶液,然后向溶液中加入稀盐酸,产生二氧化碳的量如右图所示.回答下列问题.
(2009?海淀区二模)某小组称取18.6g变质的氢氧化钠样品(杂质为碳酸钠),配成溶液,然后向溶液中加入稀盐酸,产生二氧化碳的量如右图所示.回答下列问题.(1)在变质的氢氧化钠样品中,氢氧化钠的质量为
8g
8g
.(2)稀盐酸的溶质质量分数为
7.3%
7.3%
.(3)若用该浓度的盐酸与足量的锌反应制氢气,要得到0.5g氢气,最少需要该盐酸的质量为
250g
250g
.分析:(1)根据题意可以知道生成了二氧化碳,可以根据化学方程式求算出碳酸钠的质量进而求算出氢氧化钠的质量;
(2)根据化学方程式计算出氯化氢的质量,然后结合质量分数的计算公式计算出盐酸的质量分数;
(3)根据锌与盐酸的反应的化学方程式可以计算出所需盐酸的质量.
(2)根据化学方程式计算出氯化氢的质量,然后结合质量分数的计算公式计算出盐酸的质量分数;
(3)根据锌与盐酸的反应的化学方程式可以计算出所需盐酸的质量.
解答:解:(1)由图表可知反应开始消耗100g盐酸是和氢氧化钠反应,继续消耗100g盐酸是和碳酸钠反应,且生成了二氧化碳气体4.4g;
设样品中碳酸钠质量为x,与碳酸钠反应消耗氯化氢的质量为y,则:
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 44
x y 4.4g
=
=
解得:x=10.6g,y=7.3g
所以氢氧化钠的质量为:18.6g-10.6g=8g
(2)根据题意可以知道,生成4.4g二氧化碳消耗盐酸的质量为:200g-100g=100g
所以稀盐酸的质量分数为:
×100%=7.3%
(3)设生成0.5g氢气需要消耗盐酸的质量为z,则:
Zn+2HCl═ZnCl2+H2↑
73 2
z?7.3% 0.5g
=
解得:z=250g
答:(2)稀盐酸的溶质质量分数为 7.3%;
(3)最少需要该盐酸的质量为 250g.
故答案为:(1)8g;
(2)7.3%;
(3)250g.
设样品中碳酸钠质量为x,与碳酸钠反应消耗氯化氢的质量为y,则:
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 44
x y 4.4g
| 106 |
| x |
| 44 |
| 4.4g |
| 73 |
| y |
解得:x=10.6g,y=7.3g
所以氢氧化钠的质量为:18.6g-10.6g=8g
(2)根据题意可以知道,生成4.4g二氧化碳消耗盐酸的质量为:200g-100g=100g
所以稀盐酸的质量分数为:
| 7.3g |
| 100g |
(3)设生成0.5g氢气需要消耗盐酸的质量为z,则:
Zn+2HCl═ZnCl2+H2↑
73 2
z?7.3% 0.5g
| 73 |
| 2 |
| z?7.3% |
| 0.5g |
解得:z=250g
答:(2)稀盐酸的溶质质量分数为 7.3%;
(3)最少需要该盐酸的质量为 250g.
故答案为:(1)8g;
(2)7.3%;
(3)250g.
点评:本题难度较大,主要考查了通过图象分析有价值的数据,然后根据化学方程式进行有关量的计算,培养学生的分析能力和解决问题的能力.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案
相关题目
 表示氢原子,
表示氢原子, 表示碳原子,
表示碳原子, 表示氧原子.请推断下列说法中正确的是( )
表示氧原子.请推断下列说法中正确的是( )
 ,则X的值为
,则X的值为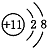 B、
B、 C、
C、 D、
D、