题目内容
16.过氧乙酸是较为常见的一种消毒剂,其化学式为CH3OOOH,(1)该物质 中碳、氢、氧三种元素的质量比6:1:12(最简比)
(2)38g过氧乙酸中含碳元素的质量是多少g.
分析 (1)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(2)根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答.
解答 解:(1)根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,可得过氧乙酸中碳、氢、氧元素的质量比为(12×2):(1×4):(16×3)=6:1:12.故填:6:1:12;
(2)38g过氧乙酸中碳元素的质量是38g×$\frac{12}{12×2+1×4+16×3}$×100%=6g;故填:6g.
点评 本题难度不大,考查同学们灵活运用化学式的有关计算进行分析问题、解决问题的能力.

练习册系列答案
相关题目
11.研制和开发不含碳并可工业生产的清洁能源,一直是科学家不懈追求的目标,目前液氨被人们被为一种潜在的清洁燃料.
①氨气在空气中充分燃烧的产物是氮气和水,试写出氨气燃烧反应的化学方程式4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.
②液氨和液氢燃料相比有关数据见表,据此判断正确的是ACD(填序号)
A.以氨和氢为燃料时,可以减缓温室效应
B.氨泄漏到空气中比氢气更易发生爆炸
C.等质量的氨和氢分别燃烧,氢放出的热量多
D.氨的液化比氢容易得多.
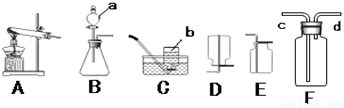
③在实验室中为探究氨气的性质,常用碱石灰和硫酸铵两种固体混合加热的方法制取氨气.通常情况下,氨气是一种极易溶于水,密度比空气小的气体.
请回答下列问题:
实验室制取氨气时发生装置A(填字母序号,下同)在C、D、E 三种装置中,收集氨气应选择D若用装置F 收集氨气,则应将d(填“c”或”d”)与发生装置相连接.
①氨气在空气中充分燃烧的产物是氮气和水,试写出氨气燃烧反应的化学方程式4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.
②液氨和液氢燃料相比有关数据见表,据此判断正确的是ACD(填序号)
| 燃料 | 沸点(℃) | 燃烧放热(kJ/g) | 相对分子质量 | 爆炸极限 | 液态密度(g/cm3) |
| 氢 | -252.6 | 119.20 | 2.0 | 4.0%~75.6% | 0.07 |
| 氨 | -33.50 | 18.65 | 17.0 | 16%~25% | 0.61 |
B.氨泄漏到空气中比氢气更易发生爆炸
C.等质量的氨和氢分别燃烧,氢放出的热量多
D.氨的液化比氢容易得多.
③在实验室中为探究氨气的性质,常用碱石灰和硫酸铵两种固体混合加热的方法制取氨气.通常情况下,氨气是一种极易溶于水,密度比空气小的气体.
请回答下列问题:
实验室制取氨气时发生装置A(填字母序号,下同)在C、D、E 三种装置中,收集氨气应选择D若用装置F 收集氨气,则应将d(填“c”或”d”)与发生装置相连接.



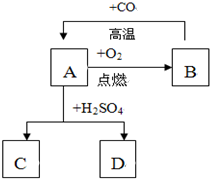 已知A、B、C、D、E是初中化学常见的物质.D物质的水溶液为浅绿色,C是密度最小的气体,它们的转化关系如图所示:
已知A、B、C、D、E是初中化学常见的物质.D物质的水溶液为浅绿色,C是密度最小的气体,它们的转化关系如图所示: