题目内容
6.写出下列反应的化学方程式(1)工厂用氢氧化钠溶液吸收二氧化硫SO2+2NaOH═Na2SO3+H2O;
(2)氢氧化铝治疗胃酸过多Al(OH)3+3HCl═AlCl3+3H2O;
(3)氢氧化钠与硫酸铜溶液反应2NaOH+CuSO4═Na2SO4+Cu(OH)2↓;
(4)氧化铜与稀硫酸反应CuO+H2SO4=CuSO4+H2O.
分析 首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可.
解答 解:(1)氢氧化钠溶液与二氧化硫反应生成亚硫酸钠和水,反应的化学方程式是:SO2+2NaOH═Na2SO3+H2O.故填:SO2+2NaOH═Na2SO3+H2O;
(2)氢氧化铝能与胃液中的盐酸反应生成氯化铝和水,反应的化学方程式为:Al(OH)3+3HCl═AlCl3+3H2O.故答案为:Al(OH)3+3HCl═AlCl3+3H2O;
(3)氢氧化钠溶液和硫酸铜溶液反应生成氢氧化铜沉淀和硫酸钠,反应的化学方程式为:2NaOH+CuSO4═Na2SO4+Cu(OH)2↓.故填:2NaOH+CuSO4═Na2SO4+Cu(OH)2↓;
(4)氧化铜和稀硫酸反应生成硫酸铜和水.氧化铜和稀硫酸反应的化学方程式为:CuO+H2SO4=CuSO4+H2O.故填:CuO+H2SO4=CuSO4+H2O.
点评 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.

练习册系列答案
相关题目
16.关于溶液的说法正确的是( )
| A. | 同种溶质的饱和溶液一定比不饱和溶液的溶质质量分数大 | |
| B. | 在某物质的饱和溶液里加入其他任何物质都不能溶解 | |
| C. | 某物质的饱和溶液,当升高温度时,若溶液的质量不变,则溶液中溶质质量分数也不变 | |
| D. | 能导电的溶液中阳离子总数一定等于阴离子总数 |
1.将一定量的空气依次通过足量的石灰水及浓硫酸,分别被除去的是( )
| A. | 二氧化碳、水蒸气 | B. | 二氧化碳、氮气 | C. | 氮气、水蒸气 | D. | 氮气、氧气 |
15.硝酸铜为蓝色固体,溶于水可得蓝色溶液.某实验小组同学用如图装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃.
【提出问题】硝酸铜在加热条件下到底发生了怎样的反应?
【查阅资料】
①氧化铜和稀硫酸反应的化学方程式:
CuO+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+H2O
②含氮化合物中,只有NO2是红棕色、有刺激性气味的气体.
③NO2有助燃性,能使带火星的木条复燃.
【猜想假设】Cu(NO3)2受热分解除了生成NO2,还可能生成了CuO和O2.
【进行实验】
(1)步骤Ⅱ是同学们查阅了新的资料后设计完成的.该资料是关于NO2助燃性、颜色变化方面的性质信息.
(2)设计步骤Ⅱ的目的是验证反应生成了氧气.
【获得结论】
根据实验结果,Cu(NO3)2受热分解的化学方程式为2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑.
【反思与评价】
(3)已知相同状况下,气体的体积比等于其分子个数比.据此,同学们认为,即使没有资料③,依据实验结论和“加热硝酸铜产生的气体能使带火星的木条复燃”的实验现象,也能推出NO2可能具有助燃性.理由:
硝酸铜分解生成的二氧化氮和氧气的体积比是4:1,氧气的体积分数是20%,和空气中氧气的体积分数大致相等,而空气中的氧气不能使带火星的木条复燃,因此NO2可能具有助燃性.
(4)一氧化氮不溶水,极易和氧气反应生成NO2;二氧化氮极易和水反应,方程式:2NO+O2═2NO2,3NO2+H2O═2HNO3+NO↑某同学在图1实验中用图2装置收集气体,结果发现图2中的集气瓶未收集到气体,且集气瓶中的液面无变化,请说明原因(用化学方程式)4NO+3O2+2H2O═4HNO3.

【提出问题】硝酸铜在加热条件下到底发生了怎样的反应?
【查阅资料】
①氧化铜和稀硫酸反应的化学方程式:
CuO+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+H2O
②含氮化合物中,只有NO2是红棕色、有刺激性气味的气体.
③NO2有助燃性,能使带火星的木条复燃.
【猜想假设】Cu(NO3)2受热分解除了生成NO2,还可能生成了CuO和O2.
【进行实验】
| 实验操作 | 实验现象 | 实验结论 |
| 步骤Ⅰ:将反应后试管中的固体加水充分溶解、过滤、将干燥后滤渣加入足量稀硫酸溶液中. | 固体全部溶解,得到蓝色溶液 | 硝酸铜分解生成了氧化铜. |
步骤Ⅱ:在图1的试管和集气瓶之间连图所示的装置,重新进行加热硝酸铜的实验.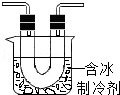 | 集气瓶中气体为无色,带火星木条复燃 | 硝酸铜分解生成了氧气 |
(2)设计步骤Ⅱ的目的是验证反应生成了氧气.
【获得结论】
根据实验结果,Cu(NO3)2受热分解的化学方程式为2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑.
【反思与评价】
(3)已知相同状况下,气体的体积比等于其分子个数比.据此,同学们认为,即使没有资料③,依据实验结论和“加热硝酸铜产生的气体能使带火星的木条复燃”的实验现象,也能推出NO2可能具有助燃性.理由:
硝酸铜分解生成的二氧化氮和氧气的体积比是4:1,氧气的体积分数是20%,和空气中氧气的体积分数大致相等,而空气中的氧气不能使带火星的木条复燃,因此NO2可能具有助燃性.
(4)一氧化氮不溶水,极易和氧气反应生成NO2;二氧化氮极易和水反应,方程式:2NO+O2═2NO2,3NO2+H2O═2HNO3+NO↑某同学在图1实验中用图2装置收集气体,结果发现图2中的集气瓶未收集到气体,且集气瓶中的液面无变化,请说明原因(用化学方程式)4NO+3O2+2H2O═4HNO3.

16.如图是李晓同学用连线的方式对某一主题知识进行归纳的情况,其中有错误的一组是( )
| A性质与用途 | B安全常识 |
| 碳有还原性-冶炼金属 乙醇有可燃性-用做燃料 活性炭有吸附性-做净水剂 | 浸泡水产品-须用甲醛水溶液 煤气泄露-严禁火种 溶洞探索-须做灯火实验 |
| C元素与人体健康 | D环保与物质的利用 |
| 人体缺铁-易患贫血症 人体缺钙-易患佝偻病 人体缺碘-甲状腺肿大 | 减少水污染-使用无磷洗衣粉 减少汽车尾气污染-使用甲醇汽油 减少酸雨的发生-使用新型能源 |
| A. | A | B. | B | C. | C | D. | D |


