题目内容
16.在盛有AgNO3、Cu(NO3)2和Zn(NO3)2混合溶液的试管中,加入一定量的铁粉充分待反应完成后过滤,下列情况是可能存在的是( )| A. | 滤纸上有Ag,滤液中有Ag+、Cu2+、Zn2+、Fe2+ | |
| B. | 滤纸上有Ag、Cu,滤液中有Ag+、Zn2+、Fe2+ | |
| C. | 滤纸上有Ag、Cu、Fe,滤液中只有Fe2+ | |
| D. | 滤纸上有Ag、Zn、Fe,滤液中有Zn2+、Fe2+ |
分析 根据在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来进行分析.
解答 解:在金属活动性顺序中,锌>铁>氢>铜>银,铁能与硝酸银反应生成银和硝酸亚铁,可以和硝酸铜反应生成铜和硝酸亚铁,不能与硝酸锌反应,所以
A、加入的铁少量,还不能将硝酸银中的银置换完,所以滤纸上有Ag,滤液中有Ag+、Cu2+、Zn2+、Fe2+,故A正确;
B、铜会将溶液中的银离子置换出来,所以滤纸上有Ag、Cu,溶液中不会含有银离子,故B错误;
C、铁的活动性没有锌强,所以不会置换出溶液中的锌离子,所以滤液中一定含有锌离子,故C错误;
D、铁的活动性没有锌强,所以不会置换出溶液中的锌离子,所以滤渣中不会含有锌,故D错误.
故选:A.
点评 本题考查了金属活动顺序表中锌、铁、铜、银的金属活动性强弱,及其金属活动性顺序表的应用,锻炼了学生分析问题解决问题的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.La(镧)是一种活动性比锌强的金属元素,其氧化物为La2O3,对应的碱La(OH)3难溶于水,而LaCl3、La(NO3)3都易溶于水.下列各组物质中,不能直接反应生成LaCl3的是( )
| A. | La+HCl | B. | La2O3+HCl | C. | NaCl+La(NO3)3 | D. | La(OH)3+HCl |
11.鉴别下列各组物质,所用试剂或方法不正确的是( )
| A. | 铜粉和氧化铁粉末-稀硫酸 | B. | 稀盐酸和碳酸钠溶液-酚酞试液 | ||
| C. | 氯化钠粉末和硝酸铵粉末-水 | D. | 氮气和二氧化碳-燃着的木条 |
8.已知某金属粉末中可能含有铁、铝、铜三种金属中的两种或三种,化学小组的同学对该粉末进行探究.
【提出猜想】
猜想一:该粉末由铜、铝组成; 猜想二:该粉末由铁、铝组成;
猜想三:该粉末由铁、铝、铜组成; 猜想四:该粉末由铁和铜组成.
【查阅资料】铝与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气,反应的化学方程式为2Al+2H2O+2NaOH=2NaAlO2+3H2↑,铁和铜与氢氧化钠溶液均不发生反应.
【供选药品】稀盐酸、稀硫酸、氢氧化钠溶液、硫酸铜溶液、澄清石灰水、蒸馏水.
【进行实验】
【反思与评价】实验中发生反应的化学方程式为Fe+2HCl=FeCl2+H2↑.
【提出猜想】
猜想一:该粉末由铜、铝组成; 猜想二:该粉末由铁、铝组成;
猜想三:该粉末由铁、铝、铜组成; 猜想四:该粉末由铁和铜组成.
【查阅资料】铝与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气,反应的化学方程式为2Al+2H2O+2NaOH=2NaAlO2+3H2↑,铁和铜与氢氧化钠溶液均不发生反应.
【供选药品】稀盐酸、稀硫酸、氢氧化钠溶液、硫酸铜溶液、澄清石灰水、蒸馏水.
【进行实验】
| 实验目的 | 实验操作 | 实验现象 | 实验结论 |
| 证明粉末中是否含有铝粉 | 取一个小烧杯,加入适量的粉末,再向其中加入足量的氢氧化钠溶液 | 无明显变化 | 猜想四成立; |
| 证明粉末中是否含有铁粉 | 过滤,将得到的固体洗涤后放入小烧杯,再向其中加入足量的稀盐酸 | 有气泡产生,固体未完全溶解 |

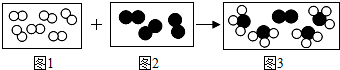
 ”和“
”和“ ”分别代表两种不同的单质分子A2和B2,它们在一定条件下能发生化学反应,其反应的微观示意图如下:
”分别代表两种不同的单质分子A2和B2,它们在一定条件下能发生化学反应,其反应的微观示意图如下: