题目内容
3.下列各项为某同学记录的化学变化中的现象,与事实不相符的是( )| A. | 稀盐酸滴入氢氧化钠溶液中无明显现象 | |
| B. | 红磷在空气中燃烧时产生浓厚白色的白雾 | |
| C. | 氢氧化钠溶液加入硫酸铜溶液产生蓝色沉淀 | |
| D. | 铁丝在氧气中燃烧时,剧烈燃烧,火星四射 |
分析 A、根据稀盐酸与氢氧化钠溶液的反应分析;
B、根据红磷在空气中燃烧的现象分析;
C、根据氢氧化钠溶液与硫酸铜溶液反应的现象分析;
D、根据铁丝在氧气中燃烧的现象分析.
解答 解:A、稀盐酸与氢氧化钠溶液反应生成了氯化钠和水,无明显现象,故A不符合题意;
B、红磷在空气中燃烧时产生浓厚白色的白烟,不是白雾,故B符合题意;
C、氢氧化钠溶液加入硫酸铜溶液产生蓝色沉淀,故C不符合题意;
D、铁丝在氧气中燃烧时,剧烈燃烧,火星四射,生成了黑色固体,故D不符合题意.
故选B.
点评 本题的难度不大,了解常见物质反应的现象是解答本题的关键.注意“烟”和“雾”的区别.

练习册系列答案
相关题目
2. 某化学实验小组对“影响石灰石与盐酸反应速率的因素-盐酸的浓度和石灰石的颗粒大小等”进行了如下实验探究,请你参与:
某化学实验小组对“影响石灰石与盐酸反应速率的因素-盐酸的浓度和石灰石的颗粒大小等”进行了如下实验探究,请你参与:
【进行实验】常温下,选用20ml不同溶质质量分数的盐酸(4%和6%)分别与1g颗粒状或块状的石灰石进行实验(固定夹持仪器略去).
(1)石灰石与盐酸反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)按如图装置进行实验,在装药品前应检查该装置的气密性,具体的做法是将导管一端浸入水中,用手紧握容器外壁,有气泡产生,开始实验时,应将20ml稀盐酸快速(选填“快速”或“缓慢”)推入锥形瓶中,以保证盐酸能全部推入锥形瓶中.
【处理数据】
(3)实验小组进行实验后,获得的相关实验数据如下表所示:
①要比较不同溶质质量分数的盐酸对反应速率的影响,可选择的实验编号是ac或是bd(写一组),由此可得到的结论是溶质质量分数越大,反应的速率越大.
②从上述实验中得出石灰石的颗粒大小对反应速率影响的结论是颗粒越小,反应的速率越大.
【拓展延伸】
(4)下表是实验时记录生成的二氧化碳气体体积和对应的时间的一组实验数据(每间隔4s读数一次):
从上表数据可以分析得出,到20s后反应速率逐渐变小,其主要原因是反应物的浓度减小.
(5)你认为影响石灰石与盐酸反应速率的因素还有石灰石的纯度,请设计实验方案验证你的猜想.
 某化学实验小组对“影响石灰石与盐酸反应速率的因素-盐酸的浓度和石灰石的颗粒大小等”进行了如下实验探究,请你参与:
某化学实验小组对“影响石灰石与盐酸反应速率的因素-盐酸的浓度和石灰石的颗粒大小等”进行了如下实验探究,请你参与:【进行实验】常温下,选用20ml不同溶质质量分数的盐酸(4%和6%)分别与1g颗粒状或块状的石灰石进行实验(固定夹持仪器略去).
(1)石灰石与盐酸反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)按如图装置进行实验,在装药品前应检查该装置的气密性,具体的做法是将导管一端浸入水中,用手紧握容器外壁,有气泡产生,开始实验时,应将20ml稀盐酸快速(选填“快速”或“缓慢”)推入锥形瓶中,以保证盐酸能全部推入锥形瓶中.
【处理数据】
(3)实验小组进行实验后,获得的相关实验数据如下表所示:
| 实验编号 | 盐酸溶质质量分数(均取20ml) | 石灰石固体性质(均取1g) | 二氧化碳体积(ml)(均收集前30s的气体) |
| a | 4% | 颗粒 | 64.0 |
| b | 4% | 块状 | 40.4 |
| c | 6% | 颗粒 | 98.2 |
| d | 6% | 块状 | 65.3 |
②从上述实验中得出石灰石的颗粒大小对反应速率影响的结论是颗粒越小,反应的速率越大.
【拓展延伸】
(4)下表是实验时记录生成的二氧化碳气体体积和对应的时间的一组实验数据(每间隔4s读数一次):
| 时间/s | 4 | 8 | 12 | 16 | 20 | 24 | 28 | 32 | 36 | 40 |
| 气体体积/ml | 16.0 | 22.2 | 29.4 | 39.3 | 50.4 | 57.6 | 62.0 | 64.7 | 66.0 | 66.0 |
(5)你认为影响石灰石与盐酸反应速率的因素还有石灰石的纯度,请设计实验方案验证你的猜想.
9.黄曲霉(化学式为C17H12O6)广泛存在于变质的花生、玉米和谷物等农产品中,下列有关说法错误的是( )
| A. | 黄曲霉素的相对分子质量为312 | |
| B. | 黄曲霉素是一种有机物化合物 | |
| C. | 黄曲霉素中碳、氢、氧三种元素的质量比17:12:6 | |
| D. | 黄曲霉素是由碳、氢、氧三种元素组成的 |
15.下列说法正确的是( )
| A. | 镁铝合金mg和足量的盐酸反应生成H20.1g,则m可能是1 | |
| B. | 要使SO2、SO3中含有相同质量的氧元素,则SO2和SO3的分子个数比2:3 | |
| C. | 将质量分别为20%的KNO3溶液90g配制成40%的溶液,需加入45gKNO3固体 | |
| D. | 氧化钙和碳酸钙的固体混合物质量为120g,将其高温煅烧至碳酸钙完全分解,称得剩余固体的质量为84g,则原固体混合物中钙元素的质量分数为50% |
13.已知某固体粉末由CaCO3、MgCO3、KHCO3、NaHCO3四种物质中的两种组成.将该粉末与足量稀盐酸反应,生成二氧化碳气体的质量4.4g.下列说法正确的是( )
(已知:KHCO3+HCl═KCl+CO2↑+H2O;MgCO3+2HCl═MgCl2+CO2↑+H2O)
(已知:KHCO3+HCl═KCl+CO2↑+H2O;MgCO3+2HCl═MgCl2+CO2↑+H2O)
| A. | 若固体粉末质量为9克,则混合物的可能组成有2种 | |
| B. | 若固体粉末质量为10克,则混合物一定由CaCO3和KHCO3组成,且质量比一定为1:1 | |
| C. | 若固体粉末质量为8.4克,则混合物一定由MgCO3和NaHCO3组成,质量比可能为2:1 | |
| D. | 若无论组成成分质量如何变化,固体粉末质量为一定值,则固体一定由MgCO3和NaHCO3组成 |


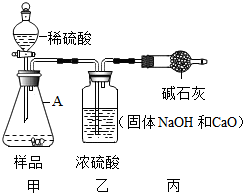 实验室贮存的烧碱易变质,围绕变质问题某学习小组同学取实验室放置了一段时间的烧碱固体样品进行下列探究,过程如下,请回答相关问题:
实验室贮存的烧碱易变质,围绕变质问题某学习小组同学取实验室放置了一段时间的烧碱固体样品进行下列探究,过程如下,请回答相关问题: