题目内容
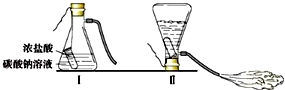
3. 某同学为了测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如图所示的装置(图中的铁架台已略去),实验步骤如下:
某同学为了测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如图所示的装置(图中的铁架台已略去),实验步骤如下:①按图连接好装置;
②称取氢氧化钠样品2克,放入A中试管内,向B中集气瓶内倒入饱和二氧化碳水溶液至瓶颈处;
③向分液漏斗中倒入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞.反应结束后,量筒中收集到饱和二氧化碳水溶液220mL.
请回答下列问题:
(1)判断氢氧化钠变质的实验现象是A中有气泡产生,氢氧化钠变质的原因是与空气中的CO2反应.因此,实验中氢氧化钠必须密封保存.
(2)在实验步骤①和②之间,还缺少一个实验步骤,该实验步骤是检查装置气密性.
(3)B中集气瓶盛装的饱和二氧化碳水溶液不能用水代替,其原因是:二氧化碳能溶于水;
(4)判断实验步骤③中滴入的稀硫酸已过量的标志是:滴入稀硫酸,A中不再有气泡产生
(5)氢氧化钠样品中碳酸钠的质量分数为:53%(CO2的密度约为2.0g/L,二氧化碳的体积等于排出的饱和二氧化碳水溶液的体积.)
(6)用上述装置不能测定已部分变质的氢氧化钠样品中氢氧化钠的质量分数,理由是氢氧化钠样品中除了碳酸钠,还有水.
分析 (1)氢氧化钠若变质,则会生成碳酸钠,那么当滴入稀硫酸时会产生气体;
(2)在实验过程有气体参与,所以必须保证装置的气密性良好;
(3)二氧化碳会溶于水;
(4)若氢氧化钠变质,则会生成气体,当不再产生气体时就说明反应完毕;
(5)根据二氧化碳的质量可以求出碳酸钠的质量,进而求出质量分数;
(6)氢氧化钠容易吸收空气中的水分而潮解;
解答 解:(1)氢氧化钠在空气中易吸收空气中的水分而潮解,然后会与空气中的二氧化碳反应而变质,所以氢氧化钠若变质,则会生成碳酸钠,那么当滴入稀硫酸时会产生二氧化碳气体,所以A中会冒出气泡,
故本题答案为:A中有气泡产生(B中收集到气体/C中收集到液体); 与空气中的CO2反应;密封;
(2)该实验过程中有气体参与,所以实验前必须检查装置的气密性,
故本题答案为:检查装置气密性;
(3)反应过程中要生成二氧化碳,而二氧化碳会和水反应或是溶于水,所以如果用水会导致实验结果的偏差,
故本题答案为:二氧化碳能溶于水;
(4)若氢氧化钠变质,当加入稀硫酸时则会生成气体,当不再产生气体时就说明反应完毕,
故本题答案为:滴入稀硫酸,A中不再有气泡产生;
(5)解:CO2的质量:m(CO2)=220mL÷1000×2.0g/L=0.44g
设样品中碳酸钠质量为X
Na2CO3 +H2SO4═Na2SO4+H2O+CO2↑
106 44
X 0.44g
$\frac{106}{X}=\frac{44}{0.44g}$,
X=1.06g
样品中碳酸钠的质量分数为:$\frac{1.06g}{2g}$×100%=53%
(6)氢氧化钠在空气中易吸收空气中的水分而潮解,然后才会与空气中的二氧化碳反应而变质,由于没有测算出水的质量,故现有的条件下难以测出氢氧化钠的质量分数,
故本题答案为:氢氧化钠样品中除了碳酸钠,还有水.
点评 熟练掌握氢氧化钠、碳酸钠的性质,知道氢氧化钠露置于空气中易变质,并会检验,记住化学方程式:Na2CO3 +2HCl═2NaCl+H2O+CO2↑,能熟练的根据化学方程式进行计算.

| A. | 图书馆图书着火,用液态二氧化碳灭火器灭火 | |
| B. | 厨房天然气、液化气泄漏时,立即打开排气扇 | |
| C. | 在加油站里加油时,用空闲时间接、打手机 | |
| D. | 电器设备着火时,先用干粉灭火器灭火再切断电源 |
(1)由于人的胃里有盐酸,因此胃液分泌过多会引起胃病,服用含有氢氧化铝的药物可缓解病痛.其治疗的化学原理为(用化学方程式表示)Al(OH)3+3HCl═AlCl3+3H2O.
(2)做馒头发酵面团时,会产生乳酸等有机酸,蒸馒头前需加进适量的纯碱或小苏打等碱性物质,它们相互作用产生了CO2气体(填化学式),使蒸出的馒头疏松多孔;若加入的碱性物质过多,可向面团或蒸锅中滴加少许含CH3COOH(填化学式)的酸性调味料,否则蒸出的馒头会变涩,颜色发黄.
(3)未成熟的水果大多具有涩味,这是因为水果里含有鞣酸.脱涩的方法之一是:先用少量的水将生石灰化成石灰乳,该变化的化学方程式是CaO+H2O=Ca(OH)2,然后把它用清水稀释,取上层清夜,浸泡水果5至6天即可除去涩味.
(4)人被昆虫叮咬后皮肤红肿起泡,这是由于昆虫在皮肤内注入了少量甲酸所致.把少许下表所列的生活常用品A或C(填编号)涂在被咬的皮肤上,痛痒便会消失.
| 物质 | A | B | C | D |
| 肥皂水 | 食醋 | 牙膏 | 食盐水 | |
| pH | 10 | 3 | 9 | 7 |
| A. | 2:3 | B. | 1:1 | C. | 1:3 | D. | 3:4 |
 海洋是丰富的化学资源宝库.通过晾晒海水,可得到含少量泥沙的粗盐.为得到比较纯净的NaCl(不考虑可溶性杂质),设计了如图所示的实验操作:
海洋是丰富的化学资源宝库.通过晾晒海水,可得到含少量泥沙的粗盐.为得到比较纯净的NaCl(不考虑可溶性杂质),设计了如图所示的实验操作: 自然界中碳氧循环过程如图所示,回答下列问题:
自然界中碳氧循环过程如图所示,回答下列问题: