题目内容
15.铁、铝、铜是常见的三种金属.生活中的铝制品和铜器表面一般不用防锈、而铁制品则需防锈处理.【提出问题】:这三种金属的活动性强弱顺序到底如何呢?
【实验探究】:同学们将粗细相同的铁丝、铝丝、铜丝分别插入等体积、等浓度的稀盐酸中:
| 操作 |  |  |  |
| 片刻后现象 | 缓慢产生少量气泡 | 无气泡 | 无气泡 |
| 几分钟后现象 | 缓慢产生少量气泡 | 快速产生大量气泡 | 无气泡 |
(1)对上述现象进行分析,三种金属的活动性由强到弱的顺序是Al>Fe>Cu(填化学式).
(2)铝丝插入稀盐酸的实验中,随着时间的变化出现了前后矛盾的现象,你猜测该过程中还发生了什么反应?Al2O3+6HCl=2AlCl3+3H2O.
【反思改进】:
(1)做验证金属的性质实验前,需对金属进行怎样的处理?打磨除锈.
(2)若只用一种金属丝和两种盐溶液也能证明三种金属的豁达性顺序,则这三种药品为Cu、Fe、Al.
分析 讨论交流:
(1)由题目中的实验现象,推测金属活动性顺序;
(2)铝丝插入稀盐酸的实验中,开始无气泡,为氧化铝与稀盐酸的反应;
反思改进:
(1)用金属在实验前,为了保持变量唯一,所以必须除锈;
(2)可采取活动性强的金属能将活动性弱的金属从其盐溶液中置换出来的反应规律,将铝插入铁与盐酸反应后的溶液中,以检验铝的活动性比铁强;
解答 解:讨论交流:
(1)对上述现象进行分析,三种金属的活动性由强到弱的顺序是 Al>Fe>Cu.
(2)铝丝插入稀盐酸的实验中,随着时间的变化出现了前后矛盾的现象,猜测该过程中还发生的反应为 Al2O3+6HCl=2AlCl3+3H2O.
反思改进:
(1)做验证金属的性质实验前,需对金属进行的处理为:打磨除锈.
(2)铜不能与盐酸反应,可先把铜放入稀盐酸,观察到无明显现象,说明铜位于氢之后;然后把铁放入该稀盐酸,铁与盐酸反应放出氢气,说明铁位于氢之前;待完全反应后,取出铁丝,插入铝丝,在铝丝表现出现黑色,说明铝的活动性比铁强.
故若只用一支盛有少量稀盐酸的试管,只需调整金属丝的插入顺序,也能证明三种金属的活动性顺序,则金属丝的插入顺序可以为 Cu、Fe、Al.
故答案为:
讨论交流:(1)Al>Fe>Cu.(2)Al2O3+6HCl=2AlCl3+3H2O.
反思改进:(1)打磨除锈.(2)Cu、Fe、Al
点评 解答本题要掌握金属活动性顺序等方面的知识,只有这样才能对相关方面的问题做出正确的判断.活动性越强的金属与酸反应越剧烈,活动性强的金属能将活动性弱的金属从其盐溶液中置换出来.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.工业制纯碱,是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,它的反应原理可用下列化学方程式表示:
NH3+CO2+H2O=NH4HCO3 …①
NH4HCO3+NaCl(饱和)=NaHCO3↓+NH4Cl …②
将所得碳酸氢钠晶体加热分解后即可得到纯碱.请回答:
(1)工业所制纯碱中常含有少量的氯化钠杂质,其原因是结晶析出的碳酸氢钠晶体表面沾有从溶液中带出的少量氯化钠.
(2)现有甲、乙两组的学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计并完成实验如下.
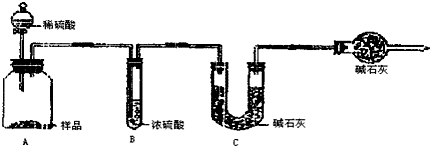
甲组:取10.00g样品,利用上图所示装置,测出反应后装置C中碱石灰的增重为3.3g.
乙组:取10.00g样品,向其中加入过量的盐酸,直至样品中无气泡冒出,加热蒸发所得物并在干燥器中冷却至室温后称量.反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g.
请分析、计算后填表:
NH3+CO2+H2O=NH4HCO3 …①
NH4HCO3+NaCl(饱和)=NaHCO3↓+NH4Cl …②
将所得碳酸氢钠晶体加热分解后即可得到纯碱.请回答:
(1)工业所制纯碱中常含有少量的氯化钠杂质,其原因是结晶析出的碳酸氢钠晶体表面沾有从溶液中带出的少量氯化钠.
(2)现有甲、乙两组的学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计并完成实验如下.

甲组:取10.00g样品,利用上图所示装置,测出反应后装置C中碱石灰的增重为3.3g.
乙组:取10.00g样品,向其中加入过量的盐酸,直至样品中无气泡冒出,加热蒸发所得物并在干燥器中冷却至室温后称量.反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g.
请分析、计算后填表:
| 分析与计算 | 计算样品中碳酸钠的质量分数 | 对实验结果的评价 | 实验失败的主要原因及对结果的影响 |
| 甲组 | 79.5% | 失败 | 加入的稀硫酸没有完全将碳酸钠反应掉,且没有冷却至室温,部分二氧化碳存在于装置内,没有被C装置内的碱石灰所吸收,造成测量结果偏小 |
| 乙组 | 99.6% | 成功 |
4.25℃时,向100g质量分数为5%的氯化钠溶液中加入5g氯化钠粉末,完全溶解后,溶液中氯化钠的质量分数为( )
| A. | 5% | B. | 9.5% | C. | 10% | D. | 无法计算 |
5.下列关于结晶和晶体的说法,错误的是( )
| A. | 饱和溶液降温析出晶体后的溶液仍然是饱和溶液 | |
| B. | 降低饱和溶液的温度不一定有晶体析出 | |
| C. | 从溶液中析出的晶体不一定有结晶水 | |
| D. | 把溶液的溶剂蒸发一些一定会有晶体析出 |


 小明从菜场买了一斤鸡蛋,放入水中煮,发现有的鸡蛋壳会破裂有的不破裂.她想:蛋壳的抗裂强度与什么因素有关呢?
小明从菜场买了一斤鸡蛋,放入水中煮,发现有的鸡蛋壳会破裂有的不破裂.她想:蛋壳的抗裂强度与什么因素有关呢?