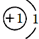题目内容
填写下表,并得出结论:

结论:
(1)元素的最外层电子数________最高正化合价.(填“>”、“<”或“=”)(2)一般情况下,最外层电子数>4时,元素的化合价________8-最外层电子数(填“>”、“<”或“=”),此时化合价一般显________价.(填“正”或“负”)
(3)一般情况下,最外层电子数<4时,原子易________电子,形成________离子,化合价一般显________价.
答案:
解析:
解析:
|
(1)= (2)=,负 (3)失去,阳,正 |

练习册系列答案
相关题目
 空气主要是由氮气和氧气组成的混合物,请你参与研究性小组有关空气成分测定和性质的实验探究.
空气主要是由氮气和氧气组成的混合物,请你参与研究性小组有关空气成分测定和性质的实验探究.(1)下图是教材中测定空气里氧气含量的实验装置.
填写下表:
| 实验现象 | 结论或解释 |
| 红磷在集气瓶中燃烧 | 反应的化学方程式为: |
| 水倒流入集气瓶中,体积 约占集气瓶体积的1/5 |
结论: |
A.装置漏气 B.红磷过量
C.温度太高 D.氮气溶解
该小组同学根据空气中氧气含量测定的实验,一致认为:氮气不能支持红磷燃烧.你认为该结论是否正确:
(2)该小组的同学对集气瓶中氮气的性质作了进一步的探究.
物理性质探究:
甲同学在实验探究中设计了如右图所示的实验装置.则该同学设计的目的是为了探究氮气的
化学性质探究:
乙同学将点燃的镁条迅速伸入集气瓶中,结果发现镁条继续燃烧,并产生黄色固体.据此,你能得出什么结论:
丙同学用天平称取2.4g表面处理过的镁条,在一个完全封闭且充满足量空气的容器中完全燃烧,产物冷却后再称量,发现固体质量小于4.0g.原因是:
氢氧化钠是一种重要的化工原料.工业上常用电解饱和食盐水的方法来制取烧碱,并生成氯气(Cl2)和氢气.
(1)请写出工业上用电解饱和食盐水制取烧碱的化学方程式: .
(2)氢氧化钠溶液中滴入酚酞试液会变红色,氢氧化钠溶液中主要含有Na+、OHˉ、水分子.某探究小组为探究氢氧化钠溶液中的哪种微粒能使酚酞试液变红,设计了如下实验方案,得出了初步结论.
①请填写下表中的实验结论:
②是否需要做“向水中滴加酚酞试液”的对比实验?为什么?
(3)某化学兴趣小组同学在实验室用氢氧化钠与稀盐酸做探究实验.将两种溶液混合后,对溶液中溶质的可能组成作出如下猜想:
甲同学的猜想是:溶液中只有NaCl.
乙同学的猜想是:溶液中可能含有NaCl、NaOH、和 HCl.
①你认为甲乙两位同学的猜想都合理吗?并说明理由.
②请你提出一个与甲乙同学不同的猜想,并设计简单的实验证明你的猜想成立.
(4)有一瓶因保存不当而部分变质的氢氧化钠固体,为测其成分,称取10g样品配制成溶液,向其中滴加一定质量分数的稀盐酸,充分反应,共放出0.88g气体,试求样品中氢氧化钠的质量分数是多少?
(1)请写出工业上用电解饱和食盐水制取烧碱的化学方程式:
(2)氢氧化钠溶液中滴入酚酞试液会变红色,氢氧化钠溶液中主要含有Na+、OHˉ、水分子.某探究小组为探究氢氧化钠溶液中的哪种微粒能使酚酞试液变红,设计了如下实验方案,得出了初步结论.
①请填写下表中的实验结论:
| 实 验 过 程 | 实验现象 | 实 验 结 论 |
| 向盛有少量NaCl溶液的试管中滴入酚酞试液,振荡 | 溶液无明显 变化 |
(3)某化学兴趣小组同学在实验室用氢氧化钠与稀盐酸做探究实验.将两种溶液混合后,对溶液中溶质的可能组成作出如下猜想:
甲同学的猜想是:溶液中只有NaCl.
乙同学的猜想是:溶液中可能含有NaCl、NaOH、和 HCl.
①你认为甲乙两位同学的猜想都合理吗?并说明理由.
②请你提出一个与甲乙同学不同的猜想,并设计简单的实验证明你的猜想成立.
(4)有一瓶因保存不当而部分变质的氢氧化钠固体,为测其成分,称取10g样品配制成溶液,向其中滴加一定质量分数的稀盐酸,充分反应,共放出0.88g气体,试求样品中氢氧化钠的质量分数是多少?
 空气主要是由氮气和氧气组成的混合物,请你参与研究性小组有关空气成分测定和性质的实验探究.
空气主要是由氮气和氧气组成的混合物,请你参与研究性小组有关空气成分测定和性质的实验探究.
(1)下图是教材中测定空气里氧气含量的实验装置.
填写下表:
| 实验现象 | 结论或解释 |
| 红磷在集气瓶中燃烧 | 反应的化学方程式为:______. |
| 水倒流入集气瓶中,体积 约占集气瓶体积的1/5 | 结论:______. |
A.装置漏气 B.红磷过量
C.温度太高 D.氮气溶解
该小组同学根据空气中氧气含量测定的实验,一致认为:氮气不能支持红磷燃烧.你认为该结论是否正确:______(选填“正确”或“错误”).
(2)该小组的同学对集气瓶中氮气的性质作了进一步的探究.
物理性质探究:
甲同学在实验探究中设计了如右图所示的实验装置.则该同学设计的目的是为了探究氮气的______.
化学性质探究:
乙同学将点燃的镁条迅速伸入集气瓶中,结果发现镁条继续燃烧,并产生黄色固体.据此,你能得出什么结论:______.
丙同学用天平称取2.4g表面处理过的镁条,在一个完全封闭且充满足量空气的容器中完全燃烧,产物冷却后再称量,发现固体质量小于4.0g.原因是:______.

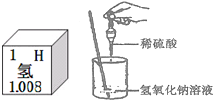 酸、碱、盐是初中化学学习的重要内容,同学们在实验室对酸、碱、盐的性质进行探究.
酸、碱、盐是初中化学学习的重要内容,同学们在实验室对酸、碱、盐的性质进行探究.