题目内容
【题目】元素符号、化学式、化合价等化学用语是学习化学的重要工具。下对化学用语中均有数字“2”①2N ②2H2O ③CO2 ④![]() ⑤Mg2+ ⑥2NO3-。其中:
⑤Mg2+ ⑥2NO3-。其中:
(1)表示离子个数的是_____。
(2)表示分子个数的是_____。
(3)表示原子个数的是_____。
(4)表示分子中原子个数是_____。
(5)表示离子所带电荷数的是_____。
(6)表示元素化合价的是_____。
【答案】⑥ ② ① ②③ ⑤ ④
【解析】
(1)标在离子符号前面的数字表示离子的个数,2NO3-中数字“2”表示2个硝酸银离子;
(2)标在分子符号前面的数字表示原子的个数,2H2O中前面数字“2”表示2个水分子;
(3)标在元素符号前面的数字表示原子的个数,2N中数字“2”表示2个氮原子;
(4)标在化学式中元素右下角的数字表示一个分子中所含原子的数目,2H2O中右下角的2表示一个水分子中含有2个氢原子,CO2中数字“2”表示1个二氧化碳分子中含有2个氧原子;
(5)标在元素符号右上角的数字表示离子所带电荷数,Mg2+中数字“2”表示一个镁离子带有两个单位的正电荷;
(6)标在元素符号正上方的数字表示该元素化合价的数值,![]() 中数字“2”表示氧化铜中铜元素的化合价为+2价。
中数字“2”表示氧化铜中铜元素的化合价为+2价。

 作业辅导系列答案
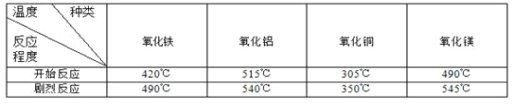
作业辅导系列答案【题目】铜、铁是人类使用最早、应用广泛的金属材料。
(1)下列金属材料不属于合金的是_____;
A 磁铁矿 B 青铜 C 铜 D 硬铝
(2)扬州博物馆的馆藏中有不少国宝级的青铜器,如:铜釭灯、铜镜、铜熏等。出土时表面有大量的“铜绿”。古时候人们大量使用青铜而不是纯铜,是因为青铜相较纯铜性能优良,例如青铜硬度比纯铜硬度_____(填“大”或“小”)。
(3)兴趣小组进行了“铜绿”产生原因的实验探究,将四小块铜片分别按下图所示放置一段时间,观察现象如下:(氢氧化钠溶液能吸收二氧化碳)
实验装置 |
|
|
|
|
实验现象 | 铜片不生锈 | 铜片不生锈 | 铜片不生锈 | 铜片生锈且水面附近锈蚀最严重 |
说明铜生锈需要水的一组实验是_____(填实验序号),写出铜产生“铜绿”的化学方程式_____。
(4)铁、铜矿石及主要成分有赤铁矿(________)、磁铁矿(Fe3O4)、黄铁矿(FeS2)、黄铜矿(CuFeS2)等。
(5)工业炼铁大多采用赤铁矿、磁铁矿。以磁铁矿为原料炼铁的化学方程式为_____。炼铁不采用黄铁矿、黄铜矿,可能的原因是:黄铁矿、黄铜矿含铁量相对低;_____。
(6)以黄铜矿为原料,采用生物炼铜是现代炼铜的新工艺,原理为:4CuFeS2+17O2+2H2SO4 4CuSO4+2Fe2(SO4)3+2H2O。向上述反应后的溶液中加入Fe粉,得到FeSO4溶液和Cu,所得FeSO4溶液颜色为_____。主要发生反应的化学方程式:Fe+Fe2(SO4)3=3FeSO4,_____。FeSO4溶液经蒸发浓缩、_____、过滤、洗涤、低温干燥等操作得到纯净的FeSO4·7H2O晶体。洗涤晶体宜用冷水,如果用热水洗涤,可能产生的后果是_____。
4CuSO4+2Fe2(SO4)3+2H2O。向上述反应后的溶液中加入Fe粉,得到FeSO4溶液和Cu,所得FeSO4溶液颜色为_____。主要发生反应的化学方程式:Fe+Fe2(SO4)3=3FeSO4,_____。FeSO4溶液经蒸发浓缩、_____、过滤、洗涤、低温干燥等操作得到纯净的FeSO4·7H2O晶体。洗涤晶体宜用冷水,如果用热水洗涤,可能产生的后果是_____。
【题目】电石主要成分是碳化钙(CaC2),它能与水反应生成一种可燃性气体及白色固体。
(资料)(1)乙炔(C2H2)燃烧时伴有大量黑烟
(2)![]() 。Ca(OH)2溶液能使酚酞变红。
。Ca(OH)2溶液能使酚酞变红。
(猜想)碳化钙与水反应生成物
(1)可燃性气体是:O2、H2或乙炔(C2H2);(2)白色固体是:氧化钙、氢氧化钙或碳酸钙,
(分析)(1)该气体不可能是O2,理由是__________。
(2)白色固体不可能是氧化钙,理由是___________。
(实验)
实验步骤 | 实验现象 | 实验结论 |
(1)取适量电石加水反应,收集生成的气体,验纯后点燃。 | 气体燃烧,产生黄色火焰并伴有浓烈黑烟。 | 电石与水反应产生的气体是______________。 |
(2)取适量反应后生成的固体于试管中,滴加过量稀盐酸。 | 固体溶解,_______。 | 电石与水反应产生的固体不是碳酸钙 |
(3)取适量反应后生成的固体于试管中加水,向上层清液中滴加2-3滴__________。 | 现象:_______。 | 电石与水反应产生的固体是氢氧化钙 |
(反思)载有电石的货车可以在雨中整整燃烧一天而不熄灭,说明电石与水的反应是________(填“吸热”或“放热”)反应。