题目内容
9.图为某工厂利用粗盐水生产纯碱的工艺流程图.
①下列说法正确的是BD(填字母)
A、流程Ⅰ中加入溶液的顺序不能改变
B、流程Ⅰ将粗盐水中的SO42-、Mg2+、Ca2+转化成沉淀
C、流程Ⅰ后过滤得到三种沉淀
D、流程Ⅲ中发生的是分解反应
②流程Ⅱ中发生的主要反应为:
NH3+CO2+H2O═NH4HCO3,
NH4HCO3+NaCl═NaHCO3↓+NH4Cl.
20℃时,向100g水中加入11.7gNaCl和15.8g NH4HCO3,充分反应后,理论上从溶液中析出晶体的质量为7.1g(20℃时,NaHCO3的溶解度为9.7g,NH4Cl的溶解度为37.2g).
分析 ①根据加入氯化钡溶液可以除去硫酸钠,加入氢氧化钠可以除去氯化镁,加入碳酸钠溶液可以除去氯化钙和过量的氯化钡;加热碳酸氢钠分解进行分析解答;
②根据11.7g的NaCl或15.8g的NH4HCO3,进行化学方程式计算,求得生成NaHCO3的质量,进而求出实际上从溶液中析出NaHCO3的固体质量.
解答 解:①A、加入三种溶液的顺序可以调整为:先加入过量的氢氧化钠溶液除去氯化镁,再加入过量的氯化钡溶液除去硫酸钠,最后加入过量的碳酸钠溶液除去氯化钙和过量的氯化钡,故A错误;
B、加入三种溶液能够将粗盐水中的SO42-、Mg2+、Ca2+转化为沉淀硫酸钡、氢氧化镁和碳酸钙,故B正确;
C、按流程I所加溶液的顺序除杂,过滤后得到四种沉淀,它们是硫酸钡、氢氧化镁、碳酸钙和碳酸钡,故C错误;
D、流程Ⅲ中发生的是碳酸氢钠分解为碳酸钠、水和二氧化碳,属于分解反应,故D正确.
故选:BD;
②设理论上生成的碳酸氢钠质量为x
NaCl+NH4HCO3═NaHCO3↓+NH4Cl
58.5 84
11.7g x
$\frac{58.5}{11.7g}$=$\frac{84}{x}$
x=16.8g
实际析出NaHCO3固体的质量为:16.8g-9.7g=7.1g.
故答案为:①BD;
②7.1.
点评 本题难度比较大,涉及粗盐提纯的原理、除杂的原理、侯氏制碱法的原理等理论内容,要通过该题认真总结解题思路.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
4.实验室用如图所示装置制取氧气,下列有关说法不正确的是( )


| A. | 实验前应检查装置的气密性 | |
| B. | 试管中加入的药品是MnO2和H2O | |
| C. | 待导管口产生连续均匀的气泡时才开始收集氧气 | |
| D. | 实验结束时应先从水槽中取出导管,再停止加热 |
14.如图是某兴趣小组同学设计的四个实验装置,其中实验能够成功的是( )
| A. |  探究燃烧的三个条件 | |
| B. |  验证质量守恒定律 | |
| C. |  测定空气中氧气的含量 | |
| D. |  探究铁生锈的条件 |
18.我国研制的用于航天飞机的固体推进剂是铝粉与高氯酸铵的混合物,点火时发生如下反应:2NH4ClO4$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+4X+Cl2↑+2O2↑,则X的化学式为( )
| A. | NH3 | B. | H2O | C. | ClO2 | D. | HCl |
19.2015年5月23日中国医学科学院药物研究所研究人员发现了一种新物质,并向中国专利技术局申请了专利,该物质被CAS登记为第6000万种已知结构的新物质M(化学式为C19H15N4FSO2).下列说法错误的是( )
| A. | M属于化合物 | B. | M由42个原子构成 | ||
| C. | M中氮氧原子个数比为2:1 | D. | M由六种元素组成 |
 胃液中的胃酸(0.2%~0.4%的盐酸),可以杀死食物里的细菌,确保胃和肠道的安全,同时增加胃蛋白酶的活性,帮助消化,正常人胃液每日需要盐酸溶质质量约为6.5g~7.3g,某患者每日分泌盐酸溶质质量为9.0g,为治疗胃酸过多需服用图所示抑酸剂,请计算并回答:
胃液中的胃酸(0.2%~0.4%的盐酸),可以杀死食物里的细菌,确保胃和肠道的安全,同时增加胃蛋白酶的活性,帮助消化,正常人胃液每日需要盐酸溶质质量约为6.5g~7.3g,某患者每日分泌盐酸溶质质量为9.0g,为治疗胃酸过多需服用图所示抑酸剂,请计算并回答: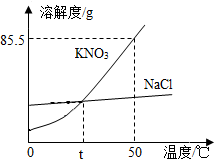 如图为KNO3、NaCl的溶解度曲线.
如图为KNO3、NaCl的溶解度曲线.
 如图是初中化学中常见物质间的转化关系.
如图是初中化学中常见物质间的转化关系.