题目内容
(1)化学实验是学习化学和进行科学研究的重要方法和途径.学会气体物质的制备方法是研究气体、利用气体的基础.请根据如图回答有关问题:
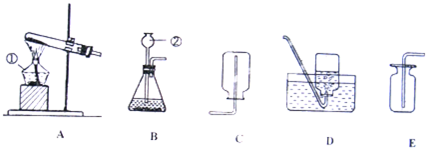
①在常温下实验室欲制取氧气所选用的装置是 (填序号),为了便于调控反应的进行,可以对发生装置进行改进,请简要说明你的改进措施 .
②从上述仪器中选择一种你比较熟悉的仪器,写出它的名称 ,简要写出它的用途 .
(2)某兴趣小组根据实验室提供的仪器和药品进行了氧气的制备实验.
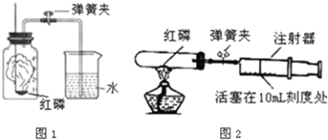
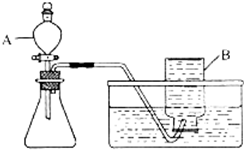 ①甲同学选用如图所示的装置制取氧气.写出仪器B的名称: .
①甲同学选用如图所示的装置制取氧气.写出仪器B的名称: .
②甲同学应选取的试剂是Mn02和 (填化学式),Mn02固体在该反应中起 作用.
③除用排水法外,甲同学还可选择 法收集氧气.
④实验前,甲同学先向仪器A中加入水,然后将导管放人水槽中,并打开仪器A的活塞,观察导管口是否有连续的气泡出现.该实验操作的目的是 .
(3)乙同学称取一定质量KMn04放在大试管中,将温度控制在250℃加热制取O2,该反应的化学方程式为 .实验结束时,乙同学发现收集到的O2大于理论产量,针对这一现象,同学们进行了如下探究:
提出猜想:猜想l:反应生成的MnO2分解放出02;
猜想Ⅱ:反应生成的K2Mn04分解放出O2
做出上述猜想的理由是 .
实验验证:同学们分为两组,分别进行以下实验:
①第一组同学取一定质量的Mn02,在250℃条件下加热一段时间,冷却后测得Mn02的质量不变.则猜想 错误.
②第二组同学取K2Mn04在250℃条件下加热,没有用测定质量的方法得出了猜想Ⅱ正确的结论.该组同学选择的实验方法是 .
拓展延伸:实验发现,K2MnO4受热只能部分分解,经分析可能是生成物K2O对其分解产生影响.请设计实验方案验证: .
实验反思:通过以上实验探究,你对“问题的发现与解决”有何认识? .
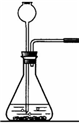 | 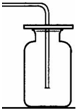 |  | 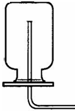 | 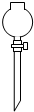 |  |
| ① | ② | ③ | ④ | ⑤ | ⑥ |
②从上述仪器中选择一种你比较熟悉的仪器,写出它的名称
(2)某兴趣小组根据实验室提供的仪器和药品进行了氧气的制备实验.
 ①甲同学选用如图所示的装置制取氧气.写出仪器B的名称:
①甲同学选用如图所示的装置制取氧气.写出仪器B的名称:②甲同学应选取的试剂是Mn02和
③除用排水法外,甲同学还可选择
④实验前,甲同学先向仪器A中加入水,然后将导管放人水槽中,并打开仪器A的活塞,观察导管口是否有连续的气泡出现.该实验操作的目的是
(3)乙同学称取一定质量KMn04放在大试管中,将温度控制在250℃加热制取O2,该反应的化学方程式为
提出猜想:猜想l:反应生成的MnO2分解放出02;
猜想Ⅱ:反应生成的K2Mn04分解放出O2
做出上述猜想的理由是
实验验证:同学们分为两组,分别进行以下实验:
①第一组同学取一定质量的Mn02,在250℃条件下加热一段时间,冷却后测得Mn02的质量不变.则猜想
②第二组同学取K2Mn04在250℃条件下加热,没有用测定质量的方法得出了猜想Ⅱ正确的结论.该组同学选择的实验方法是
拓展延伸:实验发现,K2MnO4受热只能部分分解,经分析可能是生成物K2O对其分解产生影响.请设计实验方案验证:
实验反思:通过以上实验探究,你对“问题的发现与解决”有何认识?
考点:氧气的制取装置,实验探究物质变化的条件和影响物质变化的因素,氧气的收集方法,书写化学方程式、文字表达式、电离方程式
专题:常见气体的实验室制法、检验、干燥与净化
分析:(1)①在实验室中,常温下常用过氧化氢在二氧化锰的催化作用下分解制取氧气,根据反应物的状态及反应条件确定发生装置,根据气体的性质确定收集装置,分液漏斗可以控制加入液体的量;
②试管是我们最熟悉的仪器,我们可以选择试管,并说明其作用;
(2)①熟悉常见仪器,了解名称;
②根据装置特点和实验室制氧气的原理进行判断;根据二氧化锰在反应中的表现了解作用;
③根据氧气的密度和溶水性考虑收集方法;
④实验前要检查装置的气密性;
(3)高锰酸钾分解产生了锰酸钾、二氧化锰和氧气,可以据此解答该题;
提出猜想:根据质量守恒定律可知,含有氧元素的物质才有可能生成氧气;
实验验证:①根据题中的实验现象进行解答;
②根据氧气能够支持燃烧的性质来进行解答.
拓展延伸:要探究氧化钾对高锰酸钾的分解是否有影响,可以取等量的锰酸钾固体于两支试管中,一支试管中加入,一支试管中不加入氧化钾.用同样火焰的酒精灯加热,用相同规格的集气瓶,用排水法收集一瓶气体,收集一瓶氧气所用的时间作比较,确定锰酸钾的分解是否与氧化钾有关系.
实验反思:总结实验的分析和解决过程,然后了解到需认真分析,并根据科学的方法去验证.
②试管是我们最熟悉的仪器,我们可以选择试管,并说明其作用;
(2)①熟悉常见仪器,了解名称;
②根据装置特点和实验室制氧气的原理进行判断;根据二氧化锰在反应中的表现了解作用;
③根据氧气的密度和溶水性考虑收集方法;
④实验前要检查装置的气密性;
(3)高锰酸钾分解产生了锰酸钾、二氧化锰和氧气,可以据此解答该题;
提出猜想:根据质量守恒定律可知,含有氧元素的物质才有可能生成氧气;
实验验证:①根据题中的实验现象进行解答;
②根据氧气能够支持燃烧的性质来进行解答.
拓展延伸:要探究氧化钾对高锰酸钾的分解是否有影响,可以取等量的锰酸钾固体于两支试管中,一支试管中加入,一支试管中不加入氧化钾.用同样火焰的酒精灯加热,用相同规格的集气瓶,用排水法收集一瓶气体,收集一瓶氧气所用的时间作比较,确定锰酸钾的分解是否与氧化钾有关系.
实验反思:总结实验的分析和解决过程,然后了解到需认真分析,并根据科学的方法去验证.
解答:解:(1)①在常温下,实验室常用过氧化氢在二氧化锰的催化作用下分解制取氧气,属于固液常温下反应制取气体,可用发生装置①,由于氧气的密度比空气略大,不易溶于水,可用②或⑥收集氧气;由于分液漏斗可以控制加入液体的量,所以,能改进的制取氧气的装置是①,可以把①中的长颈漏斗改成分液漏斗,控制反应式的速率;
②实验室常见仪器是试管,它可作为少量物质的反应容器.
(2)①图中B是集气瓶,集气瓶;
②该装置适合固液不加热反应,我们可以用过氧化氢溶液和固体二氧化锰反应制取氧气,其中二氧化锰在反应前后性质和质量都不发生变化,所以二氧化锰起催化作用.
③氧气的密度大于空气的密度,不易溶于水,所以除用排水法收集外,还可以用向上排空气法收集;
④这种做法可以使装置内外形成压力差,看装置是否漏气;
(3)高锰酸钾受热分解产生了锰酸钾、二氧化锰和氧气,该反应的化学方程式为:2KMnO4
K2MnO4+MnO2+O2↑;
提出猜想:根据质量守恒定律可知,含有氧元素的物质才有可能生成氧气,则:二氧化锰和锰酸钾或MnO2和K2MnO4中都含有氧元素;
实验验证:通过对二氧化锰加热,质量没有减少,所以可以判断二氧化锰不能分解产生氧气,故猜想1错误;
②根据氧气能够支持燃烧的性质可以知道,可以用带火星的木条复燃,所以可以用带火星的木条来进行检验.
拓展延伸:取等量的锰酸钾固体于两支试管中,一支试管中加入氧化钾,一支试管中不加入氧化钾,用同样火焰的酒精灯加热,用相同规格的集气瓶,用排水法收集一瓶气体,收集一瓶氧气所用的时间作比较,确定锰酸钾的分解是否与氧化钾有关系.
实验反思:要想发现问题,必须细心认真;要想解决问题,必须认真分析问题的原因所在,并用实验去验证.
故答案为:(1)①、①②或⑥;用⑤分液漏斗代替长颈漏斗;②、试管;作为少量物质的反应容器;
(2)①集气瓶;②H2O2,催化,③向上排空气法.④检查装置的气密性.
(3)2KMnO4
K2MnO4+MnO2+O2↑;
提出猜想:它们都含有氧元素;实验验证:①I;②用导出气体的导管口放一支带火星的小木条,观察到小木条复燃,则有O2生成了;
拓展延伸:为了探究氧化钾对高锰酸钾的分解是否有影响,可以取等量的锰酸钾固体于两支试管中,一支试管中加入氧化钾,一支试管中不加入氧化钾.用同样火焰的酒精灯加热,用相同规格的集气瓶,用排水法收集一瓶气体,收集一瓶氧气所用的时间作比较,确定锰酸钾的分解是否与氧化钾有关系.
实验反思:要想发现问题,必须细心认真;要想解决问题,必须认真分析问题的原因所在,并用实验去验证.
②实验室常见仪器是试管,它可作为少量物质的反应容器.
(2)①图中B是集气瓶,集气瓶;
②该装置适合固液不加热反应,我们可以用过氧化氢溶液和固体二氧化锰反应制取氧气,其中二氧化锰在反应前后性质和质量都不发生变化,所以二氧化锰起催化作用.
③氧气的密度大于空气的密度,不易溶于水,所以除用排水法收集外,还可以用向上排空气法收集;
④这种做法可以使装置内外形成压力差,看装置是否漏气;
(3)高锰酸钾受热分解产生了锰酸钾、二氧化锰和氧气,该反应的化学方程式为:2KMnO4
| ||
提出猜想:根据质量守恒定律可知,含有氧元素的物质才有可能生成氧气,则:二氧化锰和锰酸钾或MnO2和K2MnO4中都含有氧元素;
实验验证:通过对二氧化锰加热,质量没有减少,所以可以判断二氧化锰不能分解产生氧气,故猜想1错误;
②根据氧气能够支持燃烧的性质可以知道,可以用带火星的木条复燃,所以可以用带火星的木条来进行检验.
拓展延伸:取等量的锰酸钾固体于两支试管中,一支试管中加入氧化钾,一支试管中不加入氧化钾,用同样火焰的酒精灯加热,用相同规格的集气瓶,用排水法收集一瓶气体,收集一瓶氧气所用的时间作比较,确定锰酸钾的分解是否与氧化钾有关系.
实验反思:要想发现问题,必须细心认真;要想解决问题,必须认真分析问题的原因所在,并用实验去验证.
故答案为:(1)①、①②或⑥;用⑤分液漏斗代替长颈漏斗;②、试管;作为少量物质的反应容器;
(2)①集气瓶;②H2O2,催化,③向上排空气法.④检查装置的气密性.
(3)2KMnO4
| ||
提出猜想:它们都含有氧元素;实验验证:①I;②用导出气体的导管口放一支带火星的小木条,观察到小木条复燃,则有O2生成了;
拓展延伸:为了探究氧化钾对高锰酸钾的分解是否有影响,可以取等量的锰酸钾固体于两支试管中,一支试管中加入氧化钾,一支试管中不加入氧化钾.用同样火焰的酒精灯加热,用相同规格的集气瓶,用排水法收集一瓶气体,收集一瓶氧气所用的时间作比较,确定锰酸钾的分解是否与氧化钾有关系.
实验反思:要想发现问题,必须细心认真;要想解决问题,必须认真分析问题的原因所在,并用实验去验证.
点评:本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和实验方案的设计等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列物质属于溶液的是( )
| A、牛奶 | B、菜油 |
| C、生理盐水 | D、冰水 |
如图所示的基本实验操作中错误的是( )
A、 倾倒液体 |
B、 检查气密性 |
C、 收集氧气 |
D、 加热液体 |