题目内容
12.元素周期表是化学学习和研究的工具.如图是元素周期表的一部分.
(1)从表中查出铝(AL)元素的相对原子质量为26.98;
(2)11~18号元素中属于金属的有Na、Mg、Al(填元素符号);
(3)表中不同种元素最本质的区别是A(填序号);
A、质子数不同 B中子数不同 C、相对原子质量不同
(4)仅由6、8、11号三种元素中组成的一种物质的化学式为Na2CO3.
分析 (1)根据元素周期表的信息来分析;
(2)金属元素的名称汉字是钅字旁;
(3)根据元素是具有相同核电荷数(即核内质子数)的一类原子的总称,进行解答本题.
(4)根据元素组成物质及化学式的书写方法解答.
解答 解:(1)据表格可以查得铝元素的相对原子质量为26.98,故填:26.98;
(2)11~18号元素中属于金属元素的是钠元素、镁元素和铝元素,故填:Na、Mg、Al;
(3)根据元素的概念,元素是具有相同核电荷数(即核内质子数)的一类原子的总称,决定元素种类的微粒是质子数即元素的最本质区别是质子数不同.故填:A.
(4)6、8、11号元素分别为碳、氧、钠,三者可组成碳酸钠,故填:Na2CO3.
点评 本题考查了元素周期表中信息的应用,元素的定义及化学式的书写,属于基础知识考查.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
2.有5.6g不纯的铁与足量盐酸反应放出0.2g氢气.则铁中的杂质可能是( )
| A. | Al、Mg | B. | Mg、Zn | C. | Al、Zn | D. | Zn、Cu |
3.下列净化水的方法中,日常生活用水不需采纳的是( )
| A. | 沉淀 | B. | 过滤 | C. | 吸附 | D. | 蒸馏 |
20.下列试剂中,能把KOH溶液、稀硫酸、水一次鉴别出来的是( )
| A. | KCl溶液 | B. | 石蕊溶液 | C. | NaNO3溶液 | D. | 稀盐酸 |
17.某研究小组在学习氧气的化学性质时发现:铁丝燃烧没有火焰,蜡烛燃烧却有明亮的火焰.该小组同学进行了如下探究.
(1)探究一:蜡烛燃烧产生火焰的原因是什么?
点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,在另一端管口点燃,也有火焰产生.
由此可知:蜡烛燃烧产生的火焰是由气态(填“固态”或“气态”)物质燃烧形成的.
(2)探究二:物质燃烧产生火焰的根本原因是什么?
【查阅资料】
由如表可知:物质燃烧能否产生火焰与其沸点(填“熔点”或“沸点”)和燃烧时温度有关.由此推测:钠在燃烧时,有(填“有”或“没有”)火焰产生.
(3)根据硫在空气或氧气中燃烧的实验事实,请你推测:硫的沸点< 硫燃烧时的温度.(填“>”或“<”或“=”)
(1)探究一:蜡烛燃烧产生火焰的原因是什么?
点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,在另一端管口点燃,也有火焰产生.
由此可知:蜡烛燃烧产生的火焰是由气态(填“固态”或“气态”)物质燃烧形成的.
(2)探究二:物质燃烧产生火焰的根本原因是什么?
【查阅资料】
| 物质 | 熔点╱℃ | 沸点╱℃ | 燃烧时温度╱℃ |
| 石蜡 | 50∽70 | 300∽550 | 约600 |
| 铁 | 1535 | 2750 | 约1800 |
| 钠 | 97.8 | 883 | 约1400 |
(3)根据硫在空气或氧气中燃烧的实验事实,请你推测:硫的沸点< 硫燃烧时的温度.(填“>”或“<”或“=”)
1.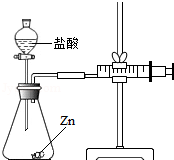 化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】
a、可能与金属本身的性质有关
b、可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入相同尝试和质量的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,发生反应的化学方程式有Fe+2HCl=FeCl2+H2↑、Zn+2HCl=ZnCl2+H2↑.
从实验现象可判断:金属活动性Zn>Fe(填“<”“=”“>”).
得出结论:金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是金属与盐酸反应的剧烈程度与金属本身性质有关(金属活动性越强,反应越剧烈).
实验(2)为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是通过注射器往右移动的体积判断生成氢气的体积.所用药品,实验数据如下表:
得出结论:金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是其他条件相同时,盐酸浓度越大,反应越剧烈.
【反思评价】根据表一中实验Ⅱ数据分析,请描述锌与盐酸发生反应快慢的变化情况并解释原因由慢到快然后逐渐减慢;锌与稀盐酸反应放热,随着反应的进行,温度升高,所以速度越来越快,一段时间后,盐酸被消耗,盐酸浓度变小,反应速率减慢.
通过以上探究,你认为金属与盐酸反应的剧烈程度可能还受哪些因素的影响温度(写一条即可).
【拓展延伸】很多金属不仅能与酸反应,也能与盐溶液反应,现将ag铁钉投入到CuSO4溶液中,反应一段时间后,将固体取出洗净、烘干,称重为bg,则生成铜的质量为8(b-a)g.
 化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】
a、可能与金属本身的性质有关
b、可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入相同尝试和质量的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,发生反应的化学方程式有Fe+2HCl=FeCl2+H2↑、Zn+2HCl=ZnCl2+H2↑.
从实验现象可判断:金属活动性Zn>Fe(填“<”“=”“>”).
得出结论:金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是金属与盐酸反应的剧烈程度与金属本身性质有关(金属活动性越强,反应越剧烈).
实验(2)为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是通过注射器往右移动的体积判断生成氢气的体积.所用药品,实验数据如下表:
| 实验编号 | 选用金属(均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
| 1分钟 | 1-2分钟 | 2-3分钟 | 3-4分钟 | 4-5分钟 | 前5分钟共收集气体 | |||
| Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.0 | 9.2 | 7.6 | 48.5 |
| Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
【反思评价】根据表一中实验Ⅱ数据分析,请描述锌与盐酸发生反应快慢的变化情况并解释原因由慢到快然后逐渐减慢;锌与稀盐酸反应放热,随着反应的进行,温度升高,所以速度越来越快,一段时间后,盐酸被消耗,盐酸浓度变小,反应速率减慢.
通过以上探究,你认为金属与盐酸反应的剧烈程度可能还受哪些因素的影响温度(写一条即可).
【拓展延伸】很多金属不仅能与酸反应,也能与盐溶液反应,现将ag铁钉投入到CuSO4溶液中,反应一段时间后,将固体取出洗净、烘干,称重为bg,则生成铜的质量为8(b-a)g.



