题目内容
18.向盛有20.0g稀硫酸的烧杯中倒入5.0g黄铜(铜锌合金)样品粉末,恰好完全反应.称得未溶物质量为3.7g.完成下列计算:(1)该黄铜样品中含Zn的质量为1.3 g
(2)所用稀硫酸中溶质的质量分数
(3)反应后所得溶液中溶质质量分数(结果保留一位小数)
分析 (1)根据金属活动性,黄铜(铜锌合金)样品中能和硫酸反应的只有锌,铜不反应;
(2)(3)根据化学方程式中锌的质量可求出参加反应的硫酸的质量,生成的硫酸锌的质量,从而得出所用稀硫酸中溶质的质量分数;然后质量守恒定律求出所得溶液的总质量,进而求出溶液中溶质的质量分数.
解答 解:(1)黄铜(铜锌合金)样品中能和硫酸反应的只有锌,铜不反应,所以锌的质量=5.0g-3.7g=1.3g;
(2)(3)解:设稀硫酸中硫酸的质量分别为X、生成硫酸锌的质量为Y,生成氢气质量为z.
Zn+H2SO4=ZnSO4+H2↑
65 98 161 2
1.3g x y z
$\frac{65}{13.g}$=$\frac{98}{x}$,解得:x=1.96g $\frac{65}{1.3g}$=$\frac{161}{y}$解得:y=3.22g;
$\frac{65}{1.3g}$=$\frac{2}{z}$,解得:z=0.04g;
稀硫酸中硫酸的质量分数=$\frac{1.96g}{20.0g}$×100%=9.8%
所得溶液中硫酸锌的质量分数=$\frac{3.22g}{20.0g+1.3g-0.04g}$×100%≈15.1%
答:稀硫酸中溶质的质量分数为9.8%;反应后所得溶液中硫酸锌的质量分数为15.1%.
点评 本题重点考查金属活动性顺序的应用,并利用化学方程式进行计算物质的质量和溶液中溶质的质量分数,要求我们能正确分析题目信息和数据.

练习册系列答案
相关题目
8.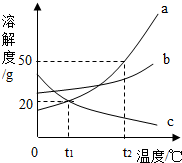 如图是三种物质的溶解度曲线,下列说法正确的是( )
如图是三种物质的溶解度曲线,下列说法正确的是( )
 如图是三种物质的溶解度曲线,下列说法正确的是( )
如图是三种物质的溶解度曲线,下列说法正确的是( )| A. | 物质c的溶解度随温度的升高而增大 | |
| B. | 物质a的溶解度大于物质c的溶解度 | |
| C. | t2℃时,60g物质a与100g水充分混合后所得溶液的总质量为160g | |
| D. | 将t1℃b、c两种物质的饱和溶液升温至t2℃,溶液中溶质质量分数不变的是b溶液 |
9.将一定质量的a,b,c,d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得各物质的质量如表:
下列有关说法正确的是( )
| 物质 | a | b | c | d |
| 反应前的质量/g | 6.4 | 14.0 | 3.2 | 1.0 |
| 反应一段时间后的质量/g | 10.0 | 7.2 | x | 1.0 |
| A. | a和b是反应物 | B. | x=3.2 | ||
| C. | 该反应属于分解反应 | D. | d一定是催化剂 |
6.下列粒子结构示意图中,属于阴离子是( )
| A. |  | B. |  | C. |  | D. |  |
9.下列变化不属于化学变化的是( )
| A. | 粮食酿酒 | B. | 盐酸除锈 | C. | 冰雪融化 | D. | 蜡烛燃烧 |
10.下列变化过程中一定含有化学变化的是( )
| A. | 氧气液化 | B. | 动植物呼吸 | C. | 蒸馏净水 | D. | 石蜡熔化 |
