题目内容
1.将10克碳酸钙加入到94.4克稀盐酸中,恰好完全反应,求反应后所得溶液中溶质质量分数.(相对相对原子质量Ca-40,C-12,O-16,H-1,Cl-35.5)
分析 碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,根据碳酸钙质量可以计算氯化钙和二氧化碳的质量,进一步可以计算反应后所得溶液中溶质质量分数.
解答 解:设生成氯化钙和二氧化碳质量分别为x、y,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 111 44
10g x y
$\frac{100}{10g}$=$\frac{111}{x}$=$\frac{44}{y}$,
x=11.1g,y=4.4g,
反应后所得溶液中溶质质量分数为:$\frac{11.1g}{10g+94.4g-4.4g}$×100%=11.1%,
答:反应后所得溶液中溶质质量分数为11.1%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.现有银、铜、铁三种金属,某研究小组的同学为探究银铁的金《活动性顺序,设 计了三个实验:I.将铁片浸入稀硫酸中;II.将银片浸入稀硫酸中;III.将铁片浸入硫酸铜溶液中.
(1)实验I的现象是:有气泡产生,溶液由无色逐渐变为浅绿色;
(2)实验Ⅲ的化学方程式是Fe+CuSO4═FeSO4+Cu;
(3)上述三个实验还不能证明的金属的活动性顺序是C.
A.铁和铜 B.铁和银 C.铜和银
(4)小红说:只需要将银、铜、铁中的两种金属分别放入CuSO4(填化学式)溶液中,即可验证这三种金属的活动性强弱.
(5)将铜片加热,铜片表面变黑.同学们设计如下实验证明此黑色物质是氧化铜.
(1)实验I的现象是:有气泡产生,溶液由无色逐渐变为浅绿色;
(2)实验Ⅲ的化学方程式是Fe+CuSO4═FeSO4+Cu;
(3)上述三个实验还不能证明的金属的活动性顺序是C.
A.铁和铜 B.铁和银 C.铜和银
(4)小红说:只需要将银、铜、铁中的两种金属分别放入CuSO4(填化学式)溶液中,即可验证这三种金属的活动性强弱.
(5)将铜片加热,铜片表面变黑.同学们设计如下实验证明此黑色物质是氧化铜.
| ①实验操作 | ②实验现象 |
| 剪下一片变黑的铜片,放入试管中,加入足量的① 稀硫酸溶液.(填“稀硫酸”或“氢氧化钠溶液”) | 铜片表面的黑色物质全部消失,露出红色的铜,溶液变为②蓝色. |
16.已知氨水的密度小于1,质量分数为25.0%的氨水与质量分数为45.0%的氨水等体积混合后,所得溶液的质量分数为( )
| A. | 等于35% | B. | 大于35% | C. | 小于35% | D. | 无法确定 |
13.下列关于水的叙述不正确的是( )
| A. | 电解水和氢气燃烧的基本反应类型相同 | |
| B. | 水是水分子构成的纯净物 | |
| C. | 净化水的常用方法有沉降、过滤、吸附和蒸馏 | |
| D. | 在硬水里用肥皂洗衣服会出现泡沫少浮渣多的现象 |
10.如图所示,王欢同学操作正确的是( )
| A. |  | B. |  | C. |  | D. |  |
8.某实验小组利用废硫酸液制备K2SO4
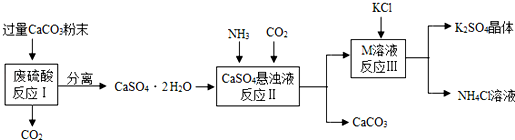
(1)将CaCO3研成粉末的目的是与硫酸充分反应.
(2)上述流程中可循环使用的物质有CO2和CaCO3(填写化学式).
(3)反应Ⅲ中相关物质的溶解度如下表.你认为反应Ⅲ在常温下能实现的原因是常温下硫酸钾的溶解度远小于氯化铵的溶解度.
(4)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是防止硫酸钾流失;为检验此晶体是否洗涤干净,可取最后一次洗涤液,先加入b(选填序号,下同),振荡、静置,再向上层清液中滴加a,观察现象即可判断.
a.AgNO3溶液 b.过量的BaCl2溶液 c.过量的Ba(NO3)2溶液.

(1)将CaCO3研成粉末的目的是与硫酸充分反应.
(2)上述流程中可循环使用的物质有CO2和CaCO3(填写化学式).
(3)反应Ⅲ中相关物质的溶解度如下表.你认为反应Ⅲ在常温下能实现的原因是常温下硫酸钾的溶解度远小于氯化铵的溶解度.
| 物质 | KCl | K2SO4 | NH4Cl | M |
| 溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
a.AgNO3溶液 b.过量的BaCl2溶液 c.过量的Ba(NO3)2溶液.


 A-H都是初中化学中常见的物质,已知A、B为黑色固体,C为气体,D为红色固体单质,F为红色固体化合物,它们的转化关系如图所示.请回答:
A-H都是初中化学中常见的物质,已知A、B为黑色固体,C为气体,D为红色固体单质,F为红色固体化合物,它们的转化关系如图所示.请回答: